
| A. | 海带中提取碘的氧化过程:H2O2+2I-+2H+=I2+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | FeCl3溶液中通入过量的H2S气体:2Fe3++H2S=S↓+2Fe2++2H+ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: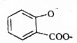 +CO2+H2O→ +CO2+H2O→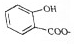 +HCO3- +HCO3- |
分析 A.过氧化氢具有强氧化性,将I-氧化为I2,符合电荷守恒、电子转移守恒与原子守恒;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:1,即NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,氢氧根先与Al3+结合生成Al(OH)3,再与铵根离子反应,最后溶解氢氧化铝;
C.FeCl3具有较强的氧化性,将H2S氧化为S,自身被还原为Fe2+,结合守恒配平判断;
D.碳酸的酸性比酚的强,与酚的钠盐反应得到酚羟基与碳酸氢盐,碳酸的酸性比羧酸的弱,不能与羧酸的钠盐反应.
解答 解:A.过氧化氢具有强氧化性,将I-氧化为I2,由电荷守恒、电子转移守恒与原子守恒可得:H2O2+2I-+2H+=I2+2H2O,故A正确;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:1,即NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,1molNH4Al(SO4)2含有1molNH4+、1molAl3+、2molSO42-,2molBa(OH)2含有4molOH-,1molAl3+转化为Al(OH)3消耗3molOH-,剩余的1molOH-恰好与1molNH4+反应,反应离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故B错误;
C.FeCl3具有较强的氧化性,将H2S氧化为S,自身被还原为Fe2+,反应离子方程式为:2Fe3++H2S=S↓+2Fe2++2H+,故C正确;
D.碳酸的酸性比酚的强,与酚的钠盐反应得到酚羟基与碳酸氢盐,碳酸的酸性比羧酸的弱,不能与羧酸的钠盐反应,反应离子方程式为: +CO2+H2O→
+CO2+H2O→ +HCO3-,故D正确.
+HCO3-,故D正确.
故选:B.
点评 本题考查离子方程式正误判断,关键是掌握元素化合物性质、官能团的结构与性质,侧重考查学生分析计算能力,注意与顺序、量有关的反应.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯德榜--创立了联合制碱法 | |
| B. | 凯库勒--首次提出了“有机化学”概念 | |
| C. | C维勒--首次用无机物合成了有机物 | |
| D. | 门捷列夫--创设了元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
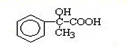
.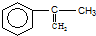 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: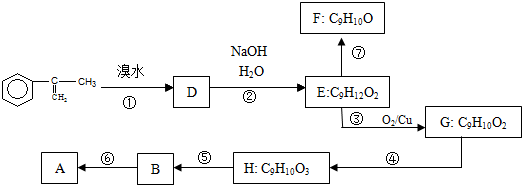
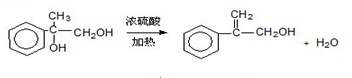 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$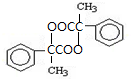 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
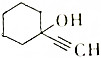 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮( 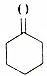 ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )| A. | 1:1 | B. | 1:2 | C. | 13:49 | D. | 24:49 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
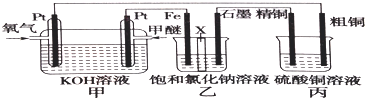
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 任何化学物质中均存在化学键 | |
| D. | 全部由非金属元素形成的化合物一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com