
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质:![]() 有光学活性,它发生下列反应后生成的有机物无光学活性的是:( )
有光学活性,它发生下列反应后生成的有机物无光学活性的是:( )
A. 与NaOH溶液共热
B. 与甲酸发生酯化反应
C. 与银氨溶液发生银镜反应
D. 在催化剂存在下与H2作用
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸反应,用下图装置进行有关实验。请回答下列问题:
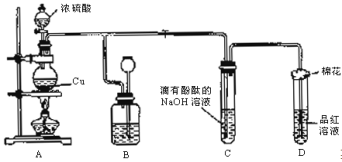
(1)装置A中发生的化学反应的化学方程式为 ;
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是 (填序号);
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2 ,而D中则是由于SO2具有 ;
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是 ;
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色,为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是 (填序号);
①观察稀H2SO4溶液呈无色
②观察CuSO4粉末呈白色
③稀释CuSO4溶液,溶液蓝色变浅
④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色
⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色
(6)若实验中用7.2g铜片和12.5mL18.0ml·L-1的浓硫酸在加热条件充分反应,最终铜片仍有剩余。根据所学的知识,某同学认为溶液中一定还有硫酸剩余,其理由是 。
假定反应前后溶液的体积不变,设剩余硫酸的浓度为amol/L,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾 mol(用含a的代数式表示,要化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
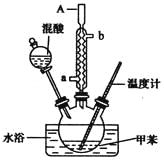
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
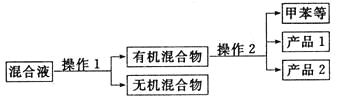
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢气、石油、煤、油脂都属于化石燃料
B.蔗糖及其水解产物均可发生银镜反应
C.分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体
D.油脂在碱性条件下的水解反应又称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切关系,下列说法错误的是( )
A.燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放
B.洪涝灾害地区的灾民用明矾和漂白粉先后处理浊水后就可直接饮用
C.人们所使用的材料,不一定是纯度越高越好
D. 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4与C2H4的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机非金属材料氮化硼(BN)可用于火箭的燃料喷嘴。已知BN可以在高温下通过:B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)2作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是
2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)2作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是
A.反应中B2O3是氧化剂
B.若消耗2.24LNH3理论上可得2.5gBN
C.填料的作用可使反应物充分接触
D.反应时NH3需要用无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】
①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
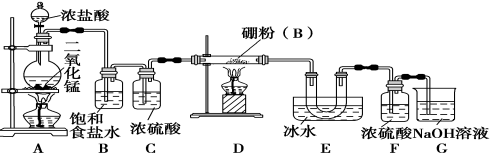
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:______________。
(2)E装置的作用是________________。
(3)写出D装置中发生反应的化学方程式:__________________;实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式________________。
(5)为了顺利完成实验,正确的操作是__________(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬用于制不锈钢,汽车零件,工具,磁带和录像带等。铬是人体必需的微量元素,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等,但铬在人体内超过一定浓度对人体健康会造成伤害。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。
请用离子方程式说明上述除杂的原理__________________。
(2)工业上为了处理含有Cr2O2- 7的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为__________。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH至少为 ,才能使Cr3+低于1×10-5 mol·L-1(国家允许的排放标准之内)。
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,需用绿矾的质量为 kg。(保留到
小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com