
【题目】铬用于制不锈钢,汽车零件,工具,磁带和录像带等。铬是人体必需的微量元素,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等,但铬在人体内超过一定浓度对人体健康会造成伤害。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。
请用离子方程式说明上述除杂的原理__________________。
(2)工业上为了处理含有Cr2O2- 7的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为__________。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH至少为 ,才能使Cr3+低于1×10-5 mol·L-1(国家允许的排放标准之内)。
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,需用绿矾的质量为 kg。(保留到
小数点后一位)
【答案】(1) FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq)
(2)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
②5
③125.1
【解析】
试题分析:(1)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq)。
故答案为:FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);
(2)①工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO47H2O)把废水中的六价铬离子还原
成三价铬离子,Cr2O72-的酸性工业废水中加入硫酸亚铁反应生成铁离子,三价铬离子和水,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②常温下,Cr3+沉淀完全浓度小于10-5mol/L,Cr(OH)3的溶度积Ksp=1×10-32=c(Cr3+)c3(OH-),c3(OH-)=![]() =10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=
=10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=![]() =10-5(mol/L),溶液pH=5。
=10-5(mol/L),溶液pH=5。
故答案为:5;
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,铬元素物质的量=![]() =150mol,Cr2O72-物质的量75mol,则
=150mol,Cr2O72-物质的量75mol,则
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
1 6
75mol 450mol
需用绿矾的质量=450mol×278g/mol=125100g=125.1kg。
故答案为:125.1。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质:![]() 有光学活性,它发生下列反应后生成的有机物无光学活性的是:( )
有光学活性,它发生下列反应后生成的有机物无光学活性的是:( )
A. 与NaOH溶液共热
B. 与甲酸发生酯化反应
C. 与银氨溶液发生银镜反应
D. 在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示。

(1)该有机物的分子式为_______________。
(2)有机物M的苯环上的二氯代物有_________种.
(3)1mol M与足量溴的CCl4溶液混合,消耗Br2的质量为_________g;
(4)1mol M与足量H2加成,消耗H2_________mol;
(5)下列有关M的说法中不正确的是
A.在催化剂的作用下,M可与液溴发生取代反应
B.M使溴水褪色的原理与乙烯使溴水褪色的原理相同
C.M能使酸性KMnO4溶液褪色
D.M和甲苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O= Cu(OH)2↓+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的一组是
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下,一定能大量共存的是( )
A. 能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B. c(H+)=1×10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
C. 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D. 水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
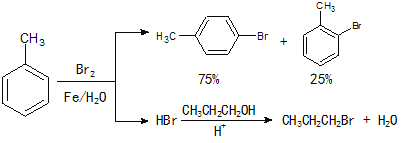
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:

①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
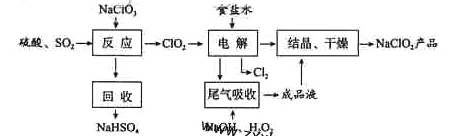
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是( )
A.二氧化硫可广泛用于食品的增白 B.葡萄糖可用于补钙药物的合成
C.聚乙烯塑料制品可用于食品的包装 D.次氯酸钠溶液可用于消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
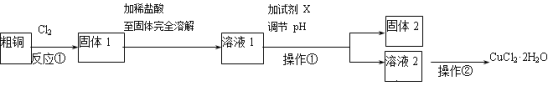
按要求回答下列问题:
(1)在进行操作①之前,要确认溶液中杂质已经完全沉淀,检验的具体操作和现象是 。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是
(3)溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)__________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→ 、 → 、 →f、g→ 。
②为了防止生成氧化铜,实验时在大试管加热前要进行一步重要操作,其操作是 。
③实验过程中,饱和食盐水中出现少许浑浊的现象,请用化学相关原理和知识解释原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com