
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
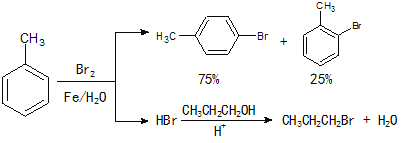
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:

①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。
【答案】(1) 水(或H2O或蒸馏水); ![]()
(2)① 冷凝管(或球形冷凝管);分液漏斗
② 吸收反应生成的HBr气体;催化剂
(3)分液;蒸馏(或分馏)
(4)滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点
【解析】
试题分析:(1)实验室存放液溴的试剂瓶需密闭,液溴为深红棕色液体,易挥发,为减少挥发,可用水封的方法保存,以减少溴的挥发;甲苯和液溴发生取代反应生成对溴甲苯的化学方程式:![]() 。
。
故答案为:水;![]() ;
;
(2)甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,然后用分液漏斗分离,粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,以此解答该题:
①依据装置图分析仪器名称和作用分析仪器a为冷凝管(或球形冷凝管),b处是加入粗产品的仪器用分液漏斗分液加入,方块b中为某玻璃仪器为分液漏斗。
故答案为:冷凝管(或球形冷凝管);分液漏斗;
②依据生成的溴化氢极易溶于水分析,三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收溴化氢,加热搅拌操作中加入浓硫酸,完成1.丙醇的取代反应,浓硫酸的作用是催化剂的作用。
故答案为:吸收反应生成的HBr气体;催化剂;
(3)依据上述分析可知操作Ⅰ时分液,操作Ⅲ为蒸馏分离方法。
故答案为:分液;蒸馏;
(4)水溶液中含有H2SO4和Fe3+,为测定HBr的物质的量,滴入氢氧化钠溶液到最后一滴生成红褐色沉淀证明溴化氢完全反应。
故答案为:滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】将15g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4与C2H4的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
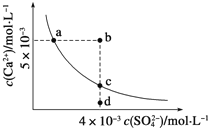
A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红色溶液X中通入气体Y,溶液逐渐褪色,下列对X、Y的推断正确的是( )
A.若X为品红溶液,则Y一定是Cl2或SO2
B.若X为含酚酞的氢氧化钠溶液,则Y可能是SO2
C.若X为含KSCN的氯化铁溶液,则Y一定是HI
D.若X为含硫酸氢钠的石蕊溶液,则Y可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬用于制不锈钢,汽车零件,工具,磁带和录像带等。铬是人体必需的微量元素,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等,但铬在人体内超过一定浓度对人体健康会造成伤害。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。
请用离子方程式说明上述除杂的原理__________________。
(2)工业上为了处理含有Cr2O2- 7的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为__________。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH至少为 ,才能使Cr3+低于1×10-5 mol·L-1(国家允许的排放标准之内)。
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,需用绿矾的质量为 kg。(保留到
小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
B.19g的H3O+ 离子中含有的电子数为11NA
C.0.5mol/LH2SO4中的H+数为NA
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示

A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材上的溶解性表时发现,CuCO3对应的为“—”,表示不存在或遇水就分解。已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水。为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验。
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀。过滤、洗涤、干燥,得到两份固体。
I.对蓝绿色沉淀成份的探究。
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为____________;
(2)试剂①为__________,证明有Cu2(OH)2SO4存在的现象为______________。
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的。

(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (_______):△m(_______)=_______时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3。
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4 ;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com