
分析 (1)生成二氧化碳的物质的量为:n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据碳原子守恒生成碳酸钙的物质的量为0.05mol,然后根据m=nM计算出生成碳酸钙的质量;
(2)混合物直接加热时只有NaHCO3分解,发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,根据方程式知,n(NaHCO3)=2n(CO2)=0.1mol,m(NaHCO3)=0.1mol×84g/mol=8.4g,则m(Na2CO3)=$\frac{27.4g}{2}$-8.4g=5.3g,n(Na2CO3)=$\frac{5.3g}{106g/mol}$=0.05mol;
(3)反应后溶液中的溶质为NaCl,根据Cl原子守恒计算HCl的物质的量浓度.
解答 解:(1)标准状况下1.12L二氧化碳的物质的量为:n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,0.05molCO2被足量的澄清石灰水吸收生成0.05mol碳酸钙沉淀,生成沉淀的质量为:100g/mol×0.05mol=5.0g,
故答案为:5.0;
(2)混合物直接加热时只有NaHCO3分解,发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,根据方程式知,n(NaHCO3)=2n(CO2)=0.1mol,m(NaHCO3)=0.1mol×84g/mol=8.4g,则m(Na2CO3)=$\frac{27.4g}{2}$-8.4g=5.3g,n(Na2CO3)=$\frac{5.3g}{106g/mol}$=0.05mol,
所以n(Na2CO3):n(NaHCO3)=0.05mol:0.1mol=1:2,
故答案为:1:2;
(3)反应后溶液中的溶质为NaCl,根据Na原子守恒得n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.1mol+0.1mol=0.2mol,
根据Cl原子守恒得n(HCl)=n(NaCl)=0.2mol,则C(HCl)=$\frac{0.2mol}{0.1L}$=2.0mol/L,
故答案为:2.0.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 漂白粉溶液在空气中发生的反应:Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| C. | 碳酸钙溶解于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氯化铁溶液与碘化钾溶液反应:Fe3++2Iˉ═Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ①②③④⑤ | C. | ②③④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
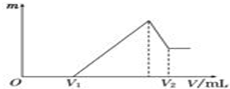 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
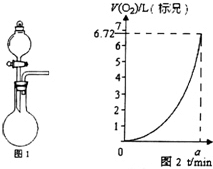 某同学探究KMnO4溶液和H2O2的反应.
某同学探究KMnO4溶液和H2O2的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷原子结构示意图 | |
| B. | 水分子的电子式 | |
| C. |  酸碱中和滴定 | |
| D. |  生产原料甲醛与氨的 物质的量之比为3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com