
| A. | 砷原子结构示意图 | |
| B. | 水分子的电子式 | |
| C. |  酸碱中和滴定 | |
| D. |  生产原料甲醛与氨的 物质的量之比为3:2 |
分析 A.砷是33号元素,有4个电子层;
B.水是共价化合物,原子间通过共用电子对形成化学键;
C.氢氧化钠溶液应盛放到碱式滴定管中;
D.将甲醛水溶液与氨水混合蒸发可制得乌洛托品,若原料完全反应生成乌洛托品,每个乌洛托品分子中含有6个C原子、4个N原子,根据C原子、N原子守恒判断甲醛和氨的物质的量之比.
解答 解:A.根据原子核外电子排布规律,砷的原子核外各层电子分别为:2,8,18,5,故A错误;
B.水是共价化合物,原子间通过共用电子对形成化学键,其电子式为 ,故B错误;
,故B错误;
C.氢氧化钠溶液应盛放到碱式滴定管中,酸式滴定管用于盛放酸性和强氧化性溶液,故C错误;
D.将甲醛水溶液与氨水混合蒸发可制得乌洛托品,若原料完全反应生成乌洛托品,每个乌洛托品分子中含有6个C原子、4个N原子,每个甲醛分子中含有1个C原子、每个氨气分子中含有1个N原子,根据C原子、N原子守恒知,要形成一个乌洛托品分子需要6个甲醛分子、4个氨气分子,则需要甲醛和氨气分子个数之比=6:4=3:2,根据N=nNA知,分子数之比等于物质的量之比,所以甲醛与氨的物质的量之比3:2,故D正确.
故选D.
点评 本题考查了电子式的书写、滴定管的选择、原子结构示意图等的概念问题,难度不大,注意基础知识的积累.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐溶液是电解质 | |
| B. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| C. | 可用NaOH溶液回收铝合金中的镁 | |
| D. | 小苏打溶液呈碱性的原因:HCO3-?OH-+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下22.4L H2中含有氢分子的个数为2NA | |
| B. | 56g Fe与稀盐酸充分反应时失去的电子数为2NA | |
| C. | 44g CO2中含有氧原子的个数为2NA | |
| D. | 1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
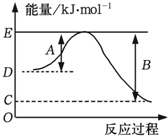 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com