
分析 (1)除去杂质碳酸钠,还不能引进杂质,可选适量稀盐酸为除杂试剂;
(2)碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,据此可除去碳酸钠中混有的碳酸氢钠;
(3)铝能够与氢氧化钠溶液反应,而铁不反应,可用氢氧化钠溶液做除杂试剂;
(4)铁离子与铁粉反应生成亚铁离子,据此可除去氯化亚铁中混有的氯化铁;
(5)二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:(1)可用稀盐酸除去混入NaCl溶液中少量Na2CO3杂质,反应的离子方程式为:2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑;
(2)可通过加热的方法除去Na2CO3粉末中混入的NaHCO3杂质,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)可用氢氧化钠溶液除去铁粉中混有铝粉,反应的撩蜂吃螫为:2Al+2OH-+2H2O=2AlO2-+H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+H2↑;
(4)除去FeCl2溶液中混有FeCl3,可加入适量铁粉,反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(5)向NaAlO2溶液中通入过量CO2,反应的离子方程式为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查了离子方程式书写、物质的分离与提纯方法,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握除杂试剂的选用方法,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
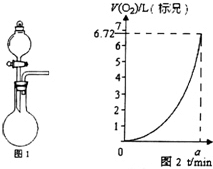 某同学探究KMnO4溶液和H2O2的反应.
某同学探究KMnO4溶液和H2O2的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )
已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | SO2 |
| 气体Y | Cl2 | HCl | Cl2 | H2S |
| A. | ②>③>①>④ | B. | ③>①=④>② | C. | ③>①>④>② | D. | ④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子的百分数不一定增大,但是化学反应速率一定增大 | |
| B. | 在化学反应前后催化剂的化学性质不变,但是由于参与化学反应导致质量减小 | |
| C. | 使用正催化剂,能降低化学反应的活化能,增大活化分子的百分数,化学反应速率一定增大 | |
| D. | 活化分子发生碰撞即可发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷原子结构示意图 | |
| B. | 水分子的电子式 | |
| C. |  酸碱中和滴定 | |
| D. |  生产原料甲醛与氨的 物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠暴露在空气中,表面变暗,生成白色的氧化钠固体 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色粉末 | |
| C. | 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 | |
| D. | 用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com