
【题目】硫酸铜晶体中结晶水含量的测定结果( )
A.可能偏小B.一定偏小, 不可能偏大
C.可能偏大D.偏大、 偏小都有可能
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上:
(1) 2-乙基丁烷 _____________________________________;
2-乙基丁烷 _____________________________________;
(2)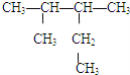 3,4-二甲基戊烷 ________________________________;
3,4-二甲基戊烷 ________________________________;
(3)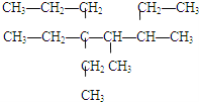 5-甲基-4,6三乙基庚烷 ____________________。
5-甲基-4,6三乙基庚烷 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:

(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A.[CrCl(H2O)5]Cl2H2O B.[CrCl2(H2O)4]Cl2H2OC.[Cr(H2O)6]Cl3D.[CrCl3(H2O)3]3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图所示的电化学装置:下列说法不正确的是

A. 乙池工作时,CO32-不断移向负极
B. 乙池负极反应为CH30H-6e-+3CO32-=4CO2+2H2O
C. 甲池中Fe电极发生的反应为2Cl- -2e-=Cl2
D. 为了使电池持续供电,工作时必须有CO2参与循环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com