
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
【答案】FeSO4 Na2O2 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 6 0.25 I-、Fe2+、Br- 2:2:1 c=1.5a + 1.5b
【解析】
I.(1)在2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe、O元素的化合价升高,O元素的化合价降低,利用氧化还原反应规律判断;
(2) ①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,根据化合价升降总数相等配平参加氧化还原反应的微粒,再结合电荷守恒、原子守恒配平其它微粒的系数;
②根据Fe元素化合价变化计算转移电子,还原产物为Cl-,根据Cl元素化合价变化计算生成Cl-的物质的量;
II.由2Fe3++2I-=2Fe2++I2和2Fe2++Br2=2Br-+2Fe3+可知,微粒的还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气首先和I-反应,然后再和Fe2+反应,最后和Br-反应。根据FeI2、FeBr2、Cl2的物质的量,结合反应的离子方程式计算。
I.(1)反应中Fe元素化合价由+2价升高为+6价,被氧化,FeSO4为还原剂;过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价,过氧化钠既是氧化剂也是还原剂。故该反应中的还原剂为FeSO4和Na2O2;
(2) ①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,Fe元素化合价升高3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低2价,化合价升降最小公倍数为6,故Fe(OH)3和FeO42-的系数为2,ClO-和Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②根据Fe元素化合价变化可知:每产生1mol FeO42-,电子转移3mol,则生成2mol FeO42-转移6mol电子;
若反应过程中转移了0.5mol电子,则还原产物的物质的量为n(Cl-)=0.5mol÷2=0.25mol;
II. (1) ①根据2Fe3++2I-=2Fe2++I2和2Fe2++Br2=2Br-+2Fe3+可知,微粒的还原性强弱顺序是:I->Fe2+>Br-。向溶液中通入氯气,氯气首先和I-反应,然后再和Fe2+反应,最后和Br-反应。向含有1mol FeI2和1mol FeBr2的溶液中通入2.5mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol I-完全反应需要氯气1mol,然后发生反应Cl2+2Fe2+=2Cl-+2Fe3+,2mol Fe2+反应需要1mol氯气,还有0.5mol氯气,发生反应:Cl2+2Br-=2Cl-+Br2,消耗1molBr-,所以被氧化的离子依次是2molI-、2molFe2+、1mol Br-,所以它们的物质的量的比是2:2:1;
②a mol FeI2完全被氧化转移3amol电子,b mol FeBr2完全被氧化转移3bmol电子,由得失电子守恒可知,当I-、Fe2+、Br-完全被氧化时,消耗氯气的物质的量为n(Cl2)=0.5×(3a+3b)mol,即c=![]() 。
。


科目:高中化学 来源: 题型:
【题目】如下是碳和碳的化合物的转化关系:
![]()
其各步转化的基本反应类型从左到右依次是( )
A. 化合、分解、置换、复分解 B. 置换、化合、复分解、分解
C. 复分解、化合、分解、置换 D. 分解、置换、化合、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 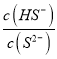 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
请回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水_________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大_______。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线
C.定容时,仰视刻度线 D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100mL的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol·L-1盐酸滴定,其用去盐酸的体积为23.0mL,则该样品中N的含量为________。
(滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3)
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是

A. 对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
B. 对于反应2A(g)+B(g)![]() C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C. 该图象表示的化学方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH < 0,y可以表示Y的百分含量
2Z(g) ΔH < 0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
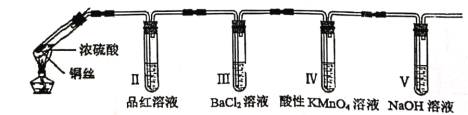
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
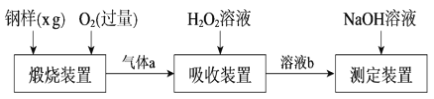
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com