
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g) ![]() 2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g) ![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将_______(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g) ![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________

a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:

①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式_______________。
【答案】 -92 10mol2/L2 逆向 bc 4OH--4e-=2H2O+O2↑ 溶液中HCO3-存在电离平衡:③HCO3-![]() H++CO32-(1分),阴极H+放电,c(H+)减小平衡右移CO32-再生(1分)答案2:阴极H+放电使c(H+)增大(1分),OH-与HCO3-反应生成CO32-(1分) CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ/mol
H++CO32-(1分),阴极H+放电,c(H+)减小平衡右移CO32-再生(1分)答案2:阴极H+放电使c(H+)增大(1分),OH-与HCO3-反应生成CO32-(1分) CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ/mol
【解析】(1)本题考查焓变与键能的关系,△H=反应物键能总和-生成物键能总和=(946+3×436-2×3×391)kJ·mol-1=-92kJ·mol-1;(2)本题考查化学平衡常数的计算,① N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始(mol·L-1)0.6 0.5 0
变化: 0.6×1/6 0.3 0.2
平衡: 0.5 0.2 0.2 根据化学平衡常数的定义,K=c2(NH3)/[c3(H2)×c(N2)]=0.22/(0.23×0.5)=10,②恒温恒压下,再通入0.9molN2,体积增大,浓度减小,平衡向逆反应方向进行;(3)本题考查化学平衡图像,a、根据勒夏特列原理,正反应方向是放热反应,等压下,升高温度,平衡向逆反应反应进行,N2的体积分数增大,即T2>T1,化学平衡常数只受温度影响,温度不变,化学平衡常数不变,即KA<KB=KC, 故错误;b、增大压强,平衡向正反应方向进行,因此C点氢气的浓度小于B点氢气浓度,故正确;c、根据密度的定义,组分都是气体,气体质量不变,A→B,气体物质的量减小,体积减小,即B点的密度大于A点,故正确;d、根据摩尔质量的定义,组分都是气体,气体的质量不变, A到C气体物质的量减小,即C点气体的物质的量小于A点,因此C点气体平均相对分子质量大于A点,故错误;(4)本题考查电解原理,①连有电源正极的电极为阳极,根据装置图,阳极反应式为4OH--4e-=O2↑+2H2O;②HCO3-溶液中存在HCO3-![]() H++CO32-,阴极反应式为2H++2e-=H2↑,消耗H+,促使平衡向正反应方向进行;③根据盖斯定律,①×3/2-②/2得到:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(-484×3/2+1352/2)kJ·mol-1=-50kJ/mol 。
H++CO32-,阴极反应式为2H++2e-=H2↑,消耗H+,促使平衡向正反应方向进行;③根据盖斯定律,①×3/2-②/2得到:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(-484×3/2+1352/2)kJ·mol-1=-50kJ/mol 。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 纤维素、光导纤维、淀粉、蛋白质都是由高分子化合物组成的物质
B. 点燃爆竹后,硫燃烧生成SO3
C. 六水合氯化钙可用作食品干燥剂
D. 食用花生油和鸡蛋清都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类生活中扮演着重要角色,以下说法或应用正确的是( )
A. 皂化反应指酯类物质发生碱性水解
B. 光导纤维和合成纤维都属于有机高分子材料
C. 苯酚,甲醛通过加聚反应可制得酚醛树脂
D. 煤经气化和液化两个化学变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是:
A. 乙酸乙酯和水、酒精和水、苯酚和水
B. 二溴乙烷和水、溴苯和水、硝基苯和水
C. 甘油和水、乙醛和水、乙酸和乙醇
D. 油酸和水、甲苯和水、己烷和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是( )
A. 金属钠保存在煤油中 B. 氢氧化钠保存在带玻璃塞的试剂瓶中
C. 漂白粉长期放置在烧杯中 D. 氯水保存在无色细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、写出下列反应的离子方程式:
(1)制取氢氧化铁胶体的离子方程式:________________;
(2)在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:___________;
II、某无色溶液,其中可能存在Na+、Ba2+、AlO2﹣、S2﹣、SO32﹣、SO42﹣.取该溶液进行有关实验,实验结果如图所示:请回答: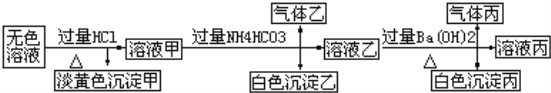
(1)生成沉淀甲的离子方程式为____________________________________________________.
(2)由溶液甲生成沉淀乙的离子方程式为______________________________________________.
(3)沉淀丙的成分为_______;
(4)综合上述信息,该溶液中肯定存在的离有:___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH |
阴离子 | OH-、Cl-、CO |
某同学进行了如下实验(必要时可加热):

下列说法正确的是( )
A. 由沉淀A推断原溶液中一定含有SO![]()
B. 原溶液中只含有NH![]() 、Fe2+、Cl-、SO
、Fe2+、Cl-、SO![]()
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L的戊烷所含的分子数为0.5 NA
B.26g乙炔所含共用电子对数目为3 NA
C.标准状况下,11.2 L CCl4所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com