
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述不正确的是( )
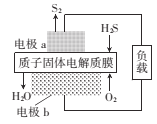
A.电池工作时,化学能转化为电能和热能
B.电极b上发生的电极反应式为O2+ 4e+4H+=2H2O
C.a是负极,电池工作时,电子的流动方向是:电极a→负载→电极b→质子膜→电极a
D.当电路中通过4mol电子时,有4molH+经质子膜进入正极区
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列实验过程完成后,最终的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)3溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.无色溶液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D.无色溶液![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
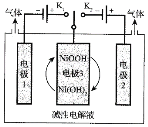
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接_______________(填K1或者K2)。产生H2的电极反应式是_____________。
②改变开关连接方式,可得O2,写出制备氧气时电极3对应的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,Y的原子半径是短周期主族元素原子中最大的,X与Z属于同一主族,Z的最外层电子数为最内层电子数的3倍。下列说法正确的是
A.原子半径: r(Y)>r(W)>r(Z)>r(X)
B.由X、Y组成的化合物中均不含共价键
C.W的氧化物对应水化物的酸性比Z的强
D.X的简单气态氢化物的热稳定性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液中加入少量铁粉,振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
B | 将Fe(NO3)2样品溶于H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
C | 向两份蛋白质溶液中分别滴加饱和硫酸钠溶液和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________________,若将负极材料改为CH4,写出其负极反应方程式_________________________。
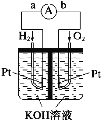
(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_______(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com