
分析 由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知KOH存在两种情况,一是KOH不足,部分Al3+转化为Al(OH)3,二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,以此计算.
解答 解:充分反应得到0.78g沉淀,Al(OH)3的物质的量为$\frac{0.78g}{78g/mol}$=0.01mol,
若KOH不足,由Al3++3OH-=Al(OH)3↓可知n(NaOH)=0.01mol×3=0.03mol,则KOH溶液的物质的量浓度是$\frac{0.03mol}{0.1L}$=0.3mol/L;
若KOH过量,则Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,
Al3++3OH-=Al(OH)3↓
0.04mol 0.12mol 0.04mol
Al(OH)3+OH-=AlO2-+2H2O,
(0.04-0.01)mol 0.03mol
故KOH溶液的物质的量浓度为$\frac{0.12mol+0.03mol}{0.1L}$=1.5mol/L,
答:KOH溶液的物质的量浓度是0.3 mol•L-1或1.5mol•L-1.
点评 本题考查化学反应的计算,为高考常见题型,把握发生的反应及物质的量关系为解答的关键,侧重于学生的分析能力和计算能力的考查,注意氢氧化铝的两性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
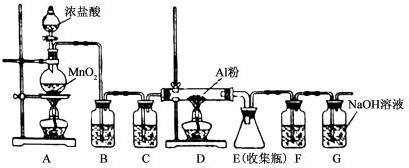
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与H2SO4溶液反应:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O | |
| C. | Na2CO3溶液与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NH4Cl 溶液显酸性:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
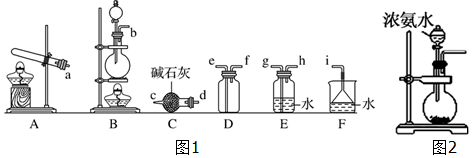
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
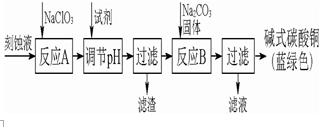 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com