
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
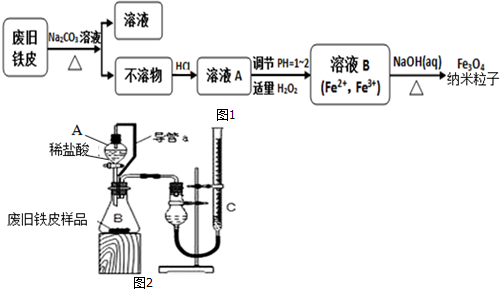
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
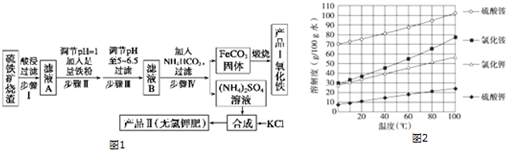
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
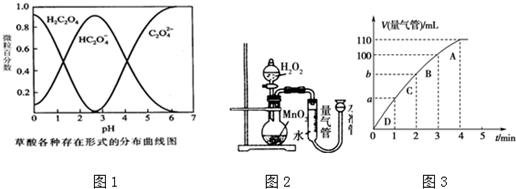
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
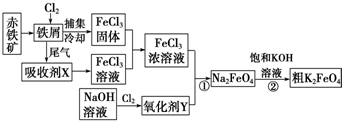
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳用于灭火 | B. | 氧气供给呼吸 | ||
| C. | 金刚石用作钻探机的钻头 | D. | 用镁制作照明弹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com