
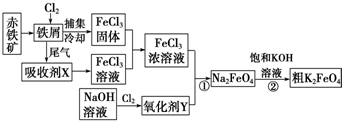
分析 氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4.
(1)依据热化学方程式 和盖斯定律计算分析判断;
(2)从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X反应生成FeCl3溶液;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-;
(4)从难溶电解质的沉淀转化的角度分析;根据方程式中物质之间的转化关系计算;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;
(2)通过工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液,
故答案为:FeCl2;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-、次氯酸钠被还原为氯离子,则反应的离子方程式为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
(4)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4);
已知2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O,2KOH+Na2FeO4═K2FeO4+2NaOH,
则 3NaClO~2Na2FeO4~2K2FeO4,
3×74.5 2×396
m 206.25t×96%
则m=$\frac{3×74.5×206.25t×96%}{2×396}$=55.875t;
故答案为:<;55.875;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌,则负极的电极反应式为:Zn+2OH--2e-═Zn(OH)2;
故答案为:Zn+2OH--2e-═Zn(OH)2.
点评 本题考查了物质的制备流程的理解应用、实验基本操作、物质性质的分析应用、反应热的计算、电极方程式的书写等,为高考常见题型,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:填空题
 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 标准状况下,22.4L盐酸含有NA个HC1分子 | |
| C. | 1Lmol•L-1的NaC1O溶液中含有C1O-的数目为NA | |
| D. | 1molNa被完成氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3{M}_{1}}$ | C. | $\frac{4m-1}{13}$mL | D. | $\frac{3}{m-n}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com