
分析 (1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,结合反应计算;
(2)铝与氧化铁在高温下生成铁与氧化铝,据此写出反应的化学方程式;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,注意铁与盐酸反应生成氯化亚铁.
解答 解:(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,测得生成的气体(标准状况,下同)体积为b L,则Al的质量为$\frac{bL}{22.4L/mol}$×$\frac{2}{3}$×27g/mol=$\frac{9b}{11.2}$g,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;$\frac{9b}{11.2}$;
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化铁与铝的质量比是160:27×2=80:27,若1mol氧化铁参与反应,转移的电子数为1mol×2×(3-0)=6mol,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;80:27;6;
(3)由方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,(2)中生成的铁的物质的量n(Fe)等于铝热剂中铝的物质的量n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
点评 本题考查氧化还原反应的计算,为高频考点,把握物质的性质、发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意转移电子的计算,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
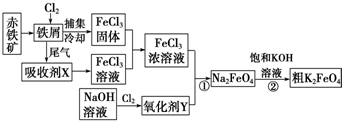
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
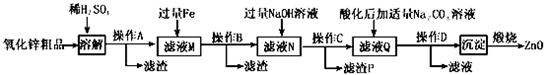
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 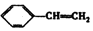 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com