
【题目】盐卤中除含有Mg2+、Cl﹣外,还含有少量Na+、Fe2+、Fe3+、SO42﹣和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
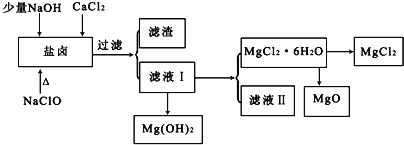
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为__________;
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是___________(用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为___________;加入NaClO的另一个作用是___________.
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是______
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________.
【答案】BCE 防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+ 3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O
或NaOH+3NaClO+ CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O 氧化Fe2+使它变成Fe(OH)3沉淀而除去 B 蓝色
【解析】
向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,CO(NH2)2和NaClO发生氧化还原反应,生成物除盐外,都是能参与大气循环的物质,所以生成物是NaCl、CO2、N2、H2O,过量二氧化碳能和NaOH反应生成碳酸氢钠,将溶液过滤得到的滤渣是Fe(OH)3,滤液I中含有Mg2+、Cl﹣、Na+,将滤液I蒸发、结晶、过滤得到MgCl26H2O,则滤液中含有的杂质离子是Na+,直接将MgCl26H2O加强热能得到MgO,发生反应MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁。
MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁。
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程,加热浓缩、冷却结晶、过滤洗涤,所以选择BCE。
(2)直接将MgCl26H2O加强热能得到MgO,同时还生成HCl和水蒸气,反应方程式为MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,为防止氯化镁水解,在制取氯化镁时,要将MgCl26H2O放在氯化氢气体中,防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+。
MgO+2HCl↑+5H2O↑,氯化镁易水解,为防止氯化镁水解,在制取氯化镁时,要将MgCl26H2O放在氯化氢气体中,防止Mg2+水解,Mg2++2H2O Mg(OH)2+2H+。
(3)通过以上分析知,该反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+ CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O,次氯酸钠具有强氧化性,能将亚铁离子氧化为铁离子,再转化为氢氧化铁沉淀而除去。
(4)①A、从盐卤或海水中获得Mg(OH)2,工业上选择生石灰作沉淀剂,故A错误;B、Mg(OH)2分解吸热,且MgO不能燃烧,所以Mg(OH)2能作阻燃剂是它分解吸热且生成MgO覆盖可燃物,故B正确;C、MgO熔点太高,工业上电解氯化镁制取镁,故C错误;故答案为B;②25℃时,Mg(OH)2的溶度积Ksp=5.6×10﹣12,根据反应Mg(OH)2(s)Mg2++2OH﹣可得:c(Mg2+)c2(OH﹣)=5.6×10﹣12,
设c(OH﹣)=2c(Mg2+)=x,则:0.5x×x2=5.6×10﹣12,
解得:x=2.24×10﹣4mol/L,
c(H+)=![]() mol/L=4.5×10﹣11mol/L,
mol/L=4.5×10﹣11mol/L,
溶液的pH=10.4>9.6,所以溶液呈蓝色。


科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(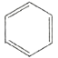 )看,78g苯中含有碳碳双键数为3NA
)看,78g苯中含有碳碳双键数为3NA
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿![]() 主要成分为
主要成分为![]() ,还有少量CuS、
,还有少量CuS、![]() 等杂质
等杂质![]() 为原料制备绿矾晶体
为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
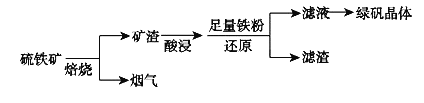
![]() “酸浸”过程,矿渣中的
“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式___________________。
反应的离子方程式___________________。
![]() 烟气中的
烟气中的![]() 会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
![]() 滤液中金属阳离子的检验方法________________________________。
滤液中金属阳离子的检验方法________________________________。
![]() 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持![]() 过量,理由___________________________。
过量,理由___________________________。![]() 结合化学用语说明原因
结合化学用语说明原因![]()
![]() 燃料细菌脱硫法是用氧化亚铁硫杆菌
燃料细菌脱硫法是用氧化亚铁硫杆菌![]() 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
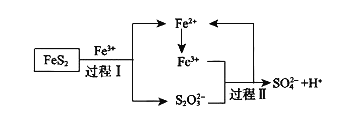
已知总反应为:![]()
![]() 将过程I离子方程式补充完整
将过程I离子方程式补充完整
____FeS2+_____Fe3++______ _______=7Fe2++________S2O32-+_____ _____
![]() 过程II反应的离子方程式___________________________________。
过程II反应的离子方程式___________________________________。
![]() 绿矾晶体在空气中易被氧化。取
绿矾晶体在空气中易被氧化。取![]() 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。反应原理:
。反应原理:![]() 。则绿矾晶体纯度的计算式为_______________。
。则绿矾晶体纯度的计算式为_______________。![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )

A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇烃化新技术是近几年合成氨工业净化精炼原料气,除去少量CO一种新方法,其原理可分为甲醇化与甲烷化两个部分。
甲醇化:![]()
![]()
甲烷化:![]()
![]()
![]() 下列措施有利于提高醇烃化过程CO转化率的是________。
下列措施有利于提高醇烃化过程CO转化率的是________。
A.及时分离出![]() 适当升高反应温度
适当升高反应温度
C.使用高效的催化剂 ![]() 适当增大压强
适当增大压强
![]() 甲醇化平衡常数可用
甲醇化平衡常数可用![]() 表示,
表示,![]() 为平衡组分中各物质的物质的量分数。若CO与
为平衡组分中各物质的物质的量分数。若CO与![]() 混合原料气中CO的体积分数为
混合原料气中CO的体积分数为![]() ,经甲醇化后CO的平衡转化率为w,则
,经甲醇化后CO的平衡转化率为w,则![]() ________
________![]() 用含w的表达式来表示
用含w的表达式来表示![]() 。
。
![]() 测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:
测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:

从上图可知选择哪种催化剂较好________![]() 填a或
填a或![]() ,理由是________。
,理由是________。
![]() 下列关于醇烃化过程说法正确的是________。
下列关于醇烃化过程说法正确的是________。
A.甲醇化与甲烷化过程在任何条件下均为自发反应
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量
C.当温度与反应容器体积一定时,在原料气中加入少量的惰性气体,有利于提高平衡转化率与甲醇的产率
D.适当增大混合气体中![]() 的百分含量,有利于提高醇烃化过程CO平衡转化率
的百分含量,有利于提高醇烃化过程CO平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
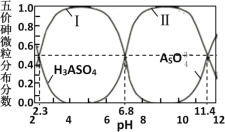
A.曲线Ⅱ代表HAsO![]() 的分布分数
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com