
 2NH3反应过程中的能量变化如下图所示,据图回答下列问题:
2NH3反应过程中的能量变化如下图所示,据图回答下列问题: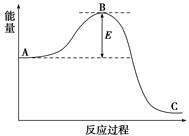
 < (3)> (4)ce
< (3)> (4)ce ;当浓度商Qc<K时,反应向右进行。
;当浓度商Qc<K时,反应向右进行。

科目:高中化学 来源:不详 题型:填空题
 2NH3(g)
2NH3(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)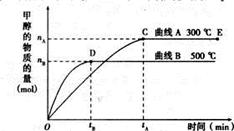
 CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是: | A.增大容器体积 | B.增大压强 | C.升高温度 | D.加催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常 数为
H2(g)+I2(g)的化学平衡常 数为 | A.0.02 | B.50 | C.100 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到限度的标志是
2Z(g)达到限度的标志是 | A.单位时间内生成3n mol X,同时消耗nmol Y |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的浓度相等 |
| D.X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 ( )
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 ( )| A.不变 | B.增大 | C.减小 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 = mol/(L·min)
= mol/(L·min)| A.升高温度 | B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )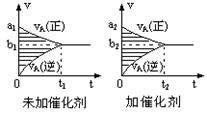
| A.b1>b2 t1>t2 | B.b1<b2t1<t2 |
| C.两图中阴影部分面积相等 | D.图II中阴影部分面积更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com