
 2Z(g)达到限度的标志是
2Z(g)达到限度的标志是 | A.单位时间内生成3n mol X,同时消耗nmol Y |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的浓度相等 |
| D.X、Y、Z的分子个数比为3:1:2 |


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( ) | A.1个N≡N键断裂的同时,有6个H—H键断裂 |
| B.1个N≡N键断裂的同时,有3个H—H键断裂 |
| C.1个N≡N键断裂的同时,有6个N—H键断裂 |
| D.1个N≡N键断裂的同时,有6个N—H键形成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
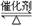 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和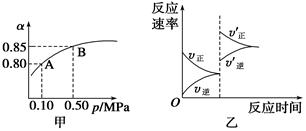
| A.由图甲知,A点SO2的平衡浓度一定为0.04 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
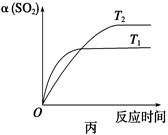
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
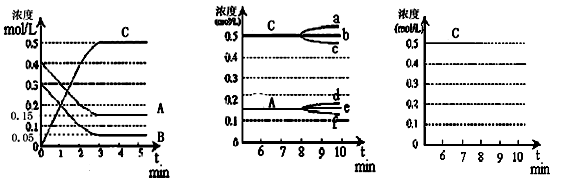
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3反应过程中的能量变化如下图所示,据图回答下列问题:
2NH3反应过程中的能量变化如下图所示,据图回答下列问题: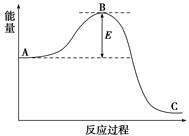
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
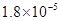 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=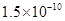
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

 mol·L-1HF溶液与
mol·L-1HF溶液与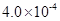 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。| A.NH4Cl | B.NH4SCN? | C.CH3COONH4 | D.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com