

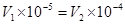 �����
�����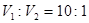 ��
��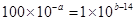 �����Ը�ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��a+b=16��pH1+pH2=16��
�����Ը�ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��a+b=16��pH1+pH2=16��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ��ƽ��ʱN2��ת����Ϊ10% |
| B����Ӧ���е�10 sĩʱ��H2��ƽ����Ӧ������0.03 mol��(L��s)��1 |
| C���÷�Ӧ�ﵽƽ��ʱ��N2��ƽ��Ũ��Ϊ0.45 mol/L |
| D���÷�Ӧ�ﵽƽ��ʱ��ѹǿ����ʼʱѹǿ��0.95�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
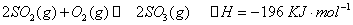 ʱ����2L�̶��ݻ����ܱ������г���2mol
ʱ����2L�̶��ݻ����ܱ������г���2mol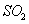 ��2mol
��2mol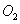 ��10���Ӻ�ﵽƽ�⣬
��10���Ӻ�ﵽƽ�⣬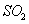 Ũ�Ⱥ�ʱ���ϵ��ͼ��
Ũ�Ⱥ�ʱ���ϵ��ͼ��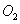 ��ƽ����Ӧ����Ϊ
��ƽ����Ӧ����Ϊ A��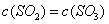 | B�����������ʵ������� |
C��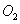 ��Ũ�ȱ��ֲ��� ��Ũ�ȱ��ֲ��� | D��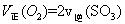 ) ) |
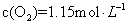 ������ͼ�ϻ���15-25����
������ͼ�ϻ���15-25����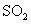 ��Ũ�ȱ仯���ߡ�
��Ũ�ȱ仯���ߡ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��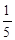 | B��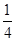 | C��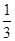 | D��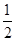 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¶Ⱥ�ѹǿһ��ʱ����Ӧ�����ƽ�����������ٸı䣻 |
| B�����¶�һ��ʱ����λʱ��������2n mol XY��ͬʱ����n mol Y2�� |
| C�����¶�һ��ʱ��������ѹǿ����ʱ��ı䣻 |
| D�����¶�һ��ʱ���κ�ʱ����X2��Y2�����ʵ���֮��Ϊ��ֵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g)
2NH3(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bB(g)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����(����)
bB(g)��ƽ������¶Ȳ��䣬�������������һ�������ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����(����)| A��ƽ�����淴Ӧ�����ƶ��� | B������A��ת���ʼ�С�� |
| C������B���������������� | D��a>b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)�ﵽ�ȵı�־��
2Z(g)�ﵽ�ȵı�־�� | A����λʱ��������3n mol X��ͬʱ����nmol Y |
| B��X������������Z������������� |
| C��X��Y��Z��Ũ����� |
| D��X��Y��Z�ķ��Ӹ�����Ϊ3:1:2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com