
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
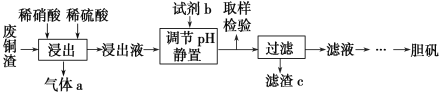
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
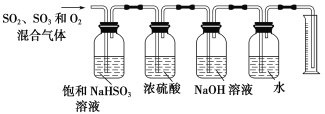
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。
【答案】3Cu + 2HNO3+ 3H2SO4=3CuSO4+ 2NO↑+ 4H2O; 向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净; CuO或Cu (OH)2或CuCO3或Cu2(OH)2 CO3; Fe(OH)3; 3NO2+H2O=2HNO3+NO; 3CuSO4![]() 3CuO + SO3↑+ 2SO2↑+ O2↑; 混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。
3CuO + SO3↑+ 2SO2↑+ O2↑; 混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。
【解析】
含少量铁的废铜渣先经稀硫酸、稀硝酸反应生成硫酸铜和硫酸铁,再加入CuO或Cu (OH)2或CuCO3或Cu2(OH)2 CO3调节溶液PH,使生成Fe(OH)3沉淀,滤液再进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到胆矾。
(1)铜与稀硫酸、稀硝酸的混合液反应生成硫酸铜,而为了不残留NO3-的杂质,NO3-要全部转化为NO。根据得失电子守恒,1molCu失去2mol电子,生成硫酸铜,1molNO3-得到3mol电子生成NO,得失电子守恒,则CuSO4和NO的比例为3:2,根据原子守恒配平,化学方程式为3Cu + 2HNO3+ 3H2SO4=3CuSO4+ 2NO↑+ 4H2O;
(2)Fe3+的检验方法是:向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)废铜渣中含有杂质铁,所以调节pH目的是促进Fe3+水解,生成Fe(OH)3沉淀,从而与CuSO4分离;,则滤渣c是Fe(OH)3;
(4)气体a是NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水又得硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,其中n(SO3)∶n(SO2)=1∶2,物质的量之比,等于化学计量数之比,根据得失电子守恒和原子守恒配平方程式得3CuSO4![]() 3CuO + SO3↑+ 2SO2↑+ O2↑;
3CuO + SO3↑+ 2SO2↑+ O2↑;
(6)SO3气体可溶解于浓硫酸中,采用98.3%的浓硫酸吸收SO3气体,SO2气体用碱液吸收,氧气用排水法测量,混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3的质量,此外排水测氧气体积时,气体应该从短导管进入,而水从长导管被气体压入量筒中。答案为混合气体通过饱和NaHSO3溶液,SO3被吸收生成硫酸,和NaHSO3反应生成SO2,没法确定SO3和SO2的质量,因此需要去掉盛饱和NaHSO3溶液的装置;此外排水量氧气的体积时,气体从短导管通入。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
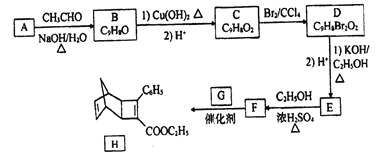
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1) E的结构简式为_______。
(2) E生成F的反应类型为_______。
(3) 1mol化合物H最多可与_______molH2发生加成反应。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______。
(5)芳香化合物X是F同分异构体,X能与饱和碳酸氢钠反应放出CO2,其核磁共振氢谱显示有4种不同化学环境氢,峰面积比之为6:2:1:1,写出1种符合要求的X的结构简式_____。
(6)写出用环戊烷和2-丁炔为原料制备化合物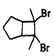 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
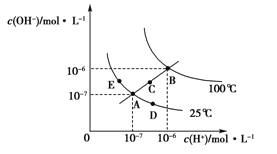
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂让汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:__________
(2)到了冬季,我国北方烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g)![]() 2NO(g) ΔH1= +180.5 kJmol-1
2NO(g) ΔH1= +180.5 kJmol-1
② CO(g)![]() C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
③ C (s)+O2(g)![]() CO2(g) ΔH3= -393.5 kJmol-1
CO2(g) ΔH3= -393.5 kJmol-1
则ΔH=_____________kJmol-1。
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:______________________________________。
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
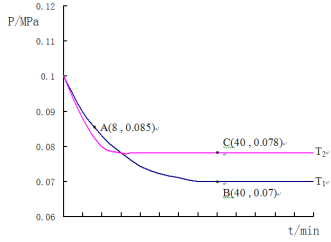
①该反应的化学平衡常数表达式:K=__________________。
②图中A点时,SO2的转化率为________________
③计算SO2催化氧化反应在图中B点的压强平衡常数K=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) ____vA(逆) (填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) △H1=akJ·mol-1
2Cu+(aq) △H1=akJ·mol-1
Cl-(aq)+Cu+(aq)![]() CuCl(s) △H2=bkJ·mol-1
CuCl(s) △H2=bkJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
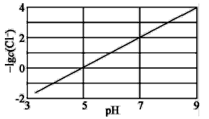
A.增加铜单质的量,有利于Cl-的去除
B.溶液pH越大,Ksp(CuCl)增大
C.反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D.![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的△H=(a+2b)kJ·mol-1
CuCl(s)的△H=(a+2b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。

1、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH="2" MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com