
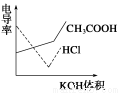
10.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
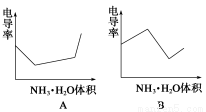
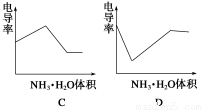
下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,卤代烃和金属钠能发生伍兹反应:RX +2Na+ RX→R-R,+2NaX,反应中有C-X键的断裂和C-C键的形成。据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名合理的是
A.一氯甲烷和2-氯丙烷:正丁烷
B.2,2-二甲基-1-氯丙烷与一氯甲烷:3,3-二甲基丁烷
C.1,5-二氯戊烷:环戊烷
D.四氯化碳:金刚石
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:选择题
下列实验现象与对应结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸气在高温下发生反应 |
D | 将某气体通入品红溶液中 | 溶液褪色 | 该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
15.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。

在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
2CH3COCH2COCH3+2e—=2(CH3COCHCOCH3)+H2↑
下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e—时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e—=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O  KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.当电解过程中转移3mole-时,理论上可制得KIO3 107g
D.电解前后溶液的pH几乎不变
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:填空题
(10分)常见化合物A、B,其焰色反应均呈黄色,C是一种单质。转化关系如图所示(其他物质均已略去)。

回答下列问题:
(1)A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,写出A的化学式__________。
(2)写出④的化学方程式______________________________________。
(3)若溶液E中仅含一种溶质,写出⑤的离子方程式______________________________。
(4)若A、B混合物在密闭容器中加热,充分反应后,只得到一种固体化合物。则A、B的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(15分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H =b kJ/mol (II)
2ClNO(g) K2 ?H =b kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com