
【题目】 “侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。

(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:

当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
【答案】
(1)除去二氧化碳中混有的氯化氢气体 饱和碳酸氢钠溶液 ;
(2)NH3·H2O+CO2+NaCl=NaHCO3↓+NH4Cl
(3)过滤、洗涤、灼烧
(4)酚酞 0.0106V/m (或甲基橙,(0.0084V-m)/62m)
(5)①HCO3-+H2O![]() H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升
H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升
②2NaHCO3![]() Na2CO3+CO2↑+H2O,温度较高时,使得碳酸氢钠受热分解为碳酸钠,溶液碱性增强
Na2CO3+CO2↑+H2O,温度较高时,使得碳酸氢钠受热分解为碳酸钠,溶液碱性增强
(6)取回复至室温的溶液少许,向其中滴加氯化钡溶液,产生白色沉淀,说明猜测合理。
【解析】
试题分析:Ⅰ.(1)盐酸有挥发性,制得的CO2中混有少量HCl,故乙装置的作用是除去二氧化碳中混有的氯化氢气体,可以用饱和碳酸氢钠溶液代替水吸收HCl;
(2)装置丙是侯氏制碱原理,发生的反应方程式为NH3·H2O+CO2+NaCl=NaHCO3↓+NH4Cl;
(3)从反应后的混合物中提出不溶物需要过滤并洗涤,最后加热灼烧使之完全分解得到纯碱,具体需要的实验操作有过滤、洗涤、灼烧;
(4)②用盐酸滴定纯碱溶液选择酚酞作指示剂;
③滴定过程发生的反应为Na2CO3+HCl=NaHCO3+H2O,n(Na2CO3)=n(HCl)=0.1V×10-3mol,样品的纯度为![]() ×100%=0.0106V/m;
×100%=0.0106V/m;
Ⅱ.(5)①AB段pH上升原因是溶液里存在HCO3-+H2O![]() H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升;
H2CO3+OH-,△H>0;升温促进水解平衡正向移动,pH上升;
②BC段pH上升原因是碳酸氢钠不稳定,受热分解生成碳酸钠,碳酸钠的水解程度大于碳酸氢钠,溶液碱性增强;
(6)结合碳酸钠与碳酸氢钠的性质差异,取回复至室温的溶液少许,向其中滴加氯化钡溶液,产生白色沉淀,说明溶液里含有碳酸钠,猜测合理。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂。
已知:氯化铜容易潮解.

I.实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜。
(1)石棉绒的作用是 ;B装置中的试剂是 。E和F装置及试剂可用_______ 替换(填装置及所装试剂)。
(2)当Cl2排尽空气后,加热D。则D中发生反应的化学方程式为 。
(3) 若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是 (一种即可)。
Ⅱ.另取纯净CuC l2固体用于制备CuCl。

(4)溶解时加入HCl溶液的目的主要是 (结合离子方程式回答)。
(5)若接上述操作用10. 0mol/L的HCl代替0.2mol/L HCl,通人SO2后,200. 00mL黄绿色溶液颜色褪去,但无白色沉淀。对此现象:
甲同学提出假设:c(H+)过大。
为验证此假设,可取75.00g CuCl2固体与100mL0.2mol/LHCl及 mL9. 8mol/LH2SO4配制成200. 00mL溶液再按上述操作进行实验。
乙同学查阅资料:体系中存在平衡2Cl-(aq)+CuCl(s)=CuCl32-(aq)。则出现此现象另一可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B,C各1.2 mol。试回答:
(1)烃A的分子式为_____________.
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气_____________L.
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有
一种,则烃A的结构简式为______________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构________种,任写出其中一种烃A的结构简式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化及海水资源的提取利用是当今化工行业重要课题。
回答下列问题:
(1)下列属于海水淡化常见工艺的是________(填序号)。
①电渗析法 ②蒸馏法 ③离子交换法 ④沉淀法
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是 Br2+Na2CO3+H2O→ NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子为________mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为____________________________________________,产品2 的化学式为________,1 L 浓海水最多可得到产品2 的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:_______________。电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有________molHCl被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型下图:

(1)等质量的以上物质完全燃烧时耗去O2的量最多的是___________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是___________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________________;
(4)在120℃、1.01×l05Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是金银花的主要抗菌、抗病毒有效药理成分之一。
Ⅰ.已知绿原酸X的结构简式为
(1)X中含氧原子的官能团的名称为____ _。
(2)下列叙述正确的是 _。
①X的分子式为C16O20O9
②1molX最多能与4mol H2发生加成反应
③X能与碳酸氢钠溶液反应,且能使酸性高锰酸钾褪色
④1molX最多能与5mol NaOH反应
⑤绿原酸水解后所得两产物碳原子数之差为2
Ⅱ.绿原酸在一定条件下可合成D和对羟基苯甲酸两种医药中间体,其合成路线如下(部分反应条件未注明):

已知:R—![]() —R
—R![]() 2R—CHO
2R—CHO
(1) D是一种芳香族化合物,D的结构简式为 ;
(2)A→C的反应类型是 ;
(3)由B生成E的化学方程式为 ;
(4)F与E互为同分异构体,且F同时满足下列条件:
①遇氯化铁溶液显紫色
②能发生银镜反应
③核磁共振氢谱为4组峰,且面积比为2:2:1:1,则F的结构共有 种(不考虑立体异构),结构简式为 (任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:C4H10→C2H4+C2H6;C4H10→C H4+C3H6某化学兴趣小组为了测定丁烷裂解气中CH4和C2H6的比例关系,设计实验如下图所示:
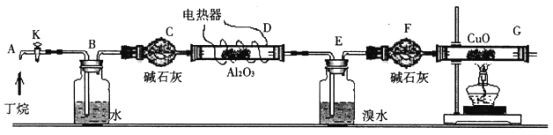
如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO2和H2O;Al2O3是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是_________(填序号)
(2)简要叙述证明空气已排尽的操作方法______________________。
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中CH4和C2H6的物质的量之比n(CH4):n(C2H6)=______________。
(4)若对实验后E装置中的混合物再按以下流程进行实验:

![]()
①分离操作I、Ⅱ的名称分别是:I、_____________,Ⅱ、____________。
②Na2SO3溶液的作用是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com