
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有________molHCl被氧化。
【答案】(1)12mol/L (2) ![]() (3) KMnO4 Cl2 (4)5xmol
(3) KMnO4 Cl2 (4)5xmol
(5)5.6L 0.5
【解析】
试题分析:(1)盐酸的物质的量浓度=![]() mol/L=12mol/L;
mol/L=12mol/L;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等;
(3)反应中锰元素化合价降低,锰元素所在的反应物KMnO4是氧化剂,氯化氢是还原剂,对应的产物是氧化产物;
(4)该反应中Mn元素化合价由+7价变为+2价,所以转移电子的物质的量=xmol×(7-2)=5xmol;
(5)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为![]() ,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol。
,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期主族元素的性质或原子结构如下表:

(1)元素Y在周期表中的位置_________(周期、族)。
(2)XN2的电子式是:_________,Y的简单氢化物的结构式_________。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________。
(4)用电子式表示WZ的形成过程_________。
(5)元素Z和T相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________。
A.常温下Z单质和T单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式_________,所得溶液的溶质是_________化合物(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
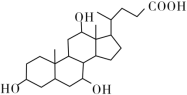
X(C24H40O5)
H2NCH2CH2CH2NHCH2CH2CH2CH2NH2 Y
下列叙述错误的是 ( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 “侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。

(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:

当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。如图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品:根据产物的质量确定有机物的组成。

回答下列问题:
(1)A中发生反应的化学方程式为 。
(2)B装置的作用是 ,燃烧管C中CuO的作用是 。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→ → 。
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,同时实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为 ,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,x可能的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有下图结构的烃分子。
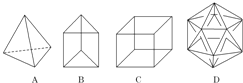
(1)结构D显然是不可能合成的,原因是____________________;
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,金刚烷的分子式为_______;
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是_________;
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异构体是生产某塑料的单体,写出合成该塑料的化学方式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com