
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
【答案】
(1)![]()
(2) 2MoS2 + 7O2 = 2MoO3 +4 SO2(高温)
(3)MoO3+Na2CO3== Na2MoO4+CO2↑
(4) MoS2+9ClO-+6OH-== MoO42-+9Cl-+2SO42-+3H2O
(5) (NH4)2CO3、(NH4)2SO3
(6) ①1:1 ②常温下浓硫酸具有强氧化性,会使铁钝化,③Cl-有利于碳素钢的腐蚀,SO42-不利于碳素钢的腐蚀
(7)nMoS2 + xLi+ + xe- = Lix(MoS2)n
【解析】
试题分析:(1)离子化合物NaClO的电子式为![]() ;
;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
(3)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(5)CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢。
(7)电池放电时正极发生还原反应,电极反应式是nMoS2 + xLi+ + xe- = Lix(MoS2)n。


科目:高中化学 来源: 题型:
【题目】短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )

A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
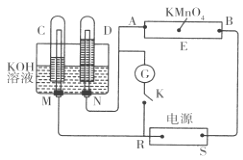
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
①负极材料为:__________发生的电极反应是: ,电流__________(填“流出”或“流入”)
②正极发生的电极反应是: ,该反应为 (填“氧化反应”或“还原反应”) 。
③若电路中转移6.02×1022个e﹣,则产生标况下H2的体积为_____ _____。
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂。
已知:氯化铜容易潮解.

I.实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜。
(1)石棉绒的作用是 ;B装置中的试剂是 。E和F装置及试剂可用_______ 替换(填装置及所装试剂)。
(2)当Cl2排尽空气后,加热D。则D中发生反应的化学方程式为 。
(3) 若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是 (一种即可)。
Ⅱ.另取纯净CuC l2固体用于制备CuCl。

(4)溶解时加入HCl溶液的目的主要是 (结合离子方程式回答)。
(5)若接上述操作用10. 0mol/L的HCl代替0.2mol/L HCl,通人SO2后,200. 00mL黄绿色溶液颜色褪去,但无白色沉淀。对此现象:
甲同学提出假设:c(H+)过大。
为验证此假设,可取75.00g CuCl2固体与100mL0.2mol/LHCl及 mL9. 8mol/LH2SO4配制成200. 00mL溶液再按上述操作进行实验。
乙同学查阅资料:体系中存在平衡2Cl-(aq)+CuCl(s)=CuCl32-(aq)。则出现此现象另一可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入400 mL 0.01 mol·L-1的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
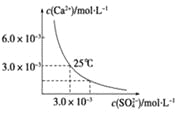
A. 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B. 溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C. 溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO 42-)都变小
D. 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________。
(3)若pH过高,则对产品的影响是________________________。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有________molHCl被氧化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com