
【题目】短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )

A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
无水乙醇性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | —114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: ,对应方程式为(注明反应类型) 。
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) 。
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种 “有刺激性气味”的气体X。你认为这种“有刺激性气味”气体X是 (填化学式)。
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下:
| C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
请回答下列问题:
D中盛放的试剂是 (填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H<0
NH2COONH4(s)△H<0
(1)制备氨基甲酸铵的装置如图1所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是__________________,液体石蜡鼓泡瓶的作用是_____________;
②从反应后的混合物中分离出产品的实验方法是_____________(填写操作名称),为了得到干燥产品,应采取的方法是_____________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如图所示,能否将浓H2SO4改为稀H2SO4_____________(填“能”或“否”),理由是_____;

(2)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g.则样品中氨基甲酸铵的质量分数为_____________。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白:
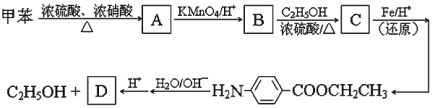
⑴ 写出化合物 B 的结构简式: 。
⑵ 由 B 到 C 的反应类型是 。
⑶ 任意写出两种同时符合下列要求的化合物 C 的同分异构体的结构简式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基;
② 分子中含有 -COO- 结构的基团。
![]()
![]()
![]()
⑷ E、F、G 中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是 (在 E、F、G 中选择,填字母)。
⑸ 一定条件下,化合物 D 发生聚合反应的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠。(1)写出相关离子方程式 。
(二)实验装置:所需实验药品和装置如下图所示:

(三)实验步骤:
(2)组装好装置,然后应该进行的操作是 。
(3)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入)。仪器A的名称是 ,选择用稀硫酸而不用稀盐酸的好处是 。
(4)先打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶。大约20分钟左右时,观察到饱和食盐水上方有 现象时,再打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。
(四)纯碱制备:
(5)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分见下图,相关物质的沸点见附表)。

附表相关物质的沸点(101kPa)

步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,_________________。
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中可能的错误有______________,冷凝管进水口是______________;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用______________;
(3)步骤2后续操作是_____________;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是____________________,加入无水MgSO4固体的作用是______________。
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约_______℃,再选择约_______℃。
A.50 B.100 C.150 D.200 E.250 F.300
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可作为合成低碳烯烃的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。

已知:H2和CH2=CH2的标准燃烧热分别是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
请回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反应在____________下自发(填“高温”或“低温”),理由是____________。
(3)计算250 ℃时该反应平衡常数的数值K=____________。
(4)下列说法正确的是____________。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
e.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。作出容器内混合气体的平均相对分子质量![]() 随时间变化的图像。
随时间变化的图像。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com