
【题目】CO2可作为合成低碳烯烃的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。

已知:H2和CH2=CH2的标准燃烧热分别是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
请回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反应在____________下自发(填“高温”或“低温”),理由是____________。
(3)计算250 ℃时该反应平衡常数的数值K=____________。
(4)下列说法正确的是____________。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
e.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。作出容器内混合气体的平均相对分子质量![]() 随时间变化的图像。
随时间变化的图像。

【答案】(1)-127.8
(2)低温;该反应的ΔH<0,ΔS<0(其他合理答案均可)
(3)0.088(或![]() )
)
(4)a、d
(5)如图, ,起点坐标为(0,12.5),t0达平衡时 应在区间(12.5,20),t2达平衡时 应大于12.5。
,起点坐标为(0,12.5),t0达平衡时 应在区间(12.5,20),t2达平衡时 应大于12.5。
【解析】
试题分析:(1)根据题意(1)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H1
CH2=CH2(g)+4H2O(g)△H1
②H2(g)+![]() O2(g)=H2O(l)△H2=-285.8kJmol-1
O2(g)=H2O(l)△H2=-285.8kJmol-1
③CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=-1411kJmol-1
④H2O(g) = H2O(l) ΔH=-44 kJ·mol-1
根据盖斯定律:②×6-③-④×4=①,则△H1=6△H2-△H3-4△H=-127.8kJmol-1;故答案为:-127.8;
(2)CO2合成CH2=CH2的反应属于熵减小的反应,根据△G=△S-T△H,反应要自发进行,△G<0,由于△S<0,△H<0,因此低温自发,故答案为:低温;该反应的ΔH<0,ΔS<0;
(3) 6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
起始(mol)3 1 0 0
反应 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)a.该反应放热,温度升高,平衡逆向移动,平衡常数减小,平衡常数大小:M>N,正确;b.温度越高,活化分子百分数越大,活化分子百分数M<N,错误;c.催化剂对化学平衡没有影响,CO2的平衡转化率不变,错误;d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,相当于充入氢气,平衡右移,CO2的平衡转化率增大,正确;e.混合气体的密度始终不变,不能说明化学反应已达到平衡状态,错误。故选a、d;
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。起始![]() =
=![]() =12.5,随着反应的进行,物质的量减小,
=12.5,随着反应的进行,物质的量减小,![]() 增大,t0达到化学平衡时,
增大,t0达到化学平衡时,![]() =
= ![]() =15.38,t1时将容器体积瞬间扩大至2V L并保持不变,相当于减小压强,平衡逆向移动,气体的物质的量增大,
=15.38,t1时将容器体积瞬间扩大至2V L并保持不变,相当于减小压强,平衡逆向移动,气体的物质的量增大,![]() 减小,但大于12.5,因此图像大致为
减小,但大于12.5,因此图像大致为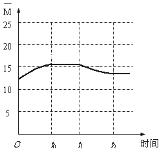 ,故答案为:
,故答案为:


科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:

已知:
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。

(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )

A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,质量为m2。下列说法正确的是( )
A.设锌镀层厚度为h,锌的密度为ρ,则h=(m1-m2)/( ρS)
B.锌电极的电极反应式为 2H2O + 2e- = H2 + 2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁皮,冲洗后用酒精灯加热烘干,铁片可能部分被氧化导致实验结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:

(1)操作Ⅱ中,通入硫化氢至饱和的目的是______________;在溶液中用硫酸酸化至pH=2的目的是______________。
(2)滤渣Ⅱ的主要成分是______________。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______________(填仪器名称).
②判断此滴定实验达到终点的方法是______________。
③计算上述样品中FeSO47H2O的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
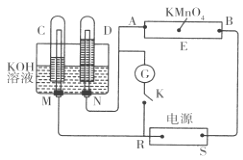
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________。
(3)若pH过高,则对产品的影响是________________________。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com