
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,质量为m2。下列说法正确的是( )
A.设锌镀层厚度为h,锌的密度为ρ,则h=(m1-m2)/( ρS)
B.锌电极的电极反应式为 2H2O + 2e- = H2 + 2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁皮,冲洗后用酒精灯加热烘干,铁片可能部分被氧化导致实验结果偏低
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。

①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠。(1)写出相关离子方程式 。
(二)实验装置:所需实验药品和装置如下图所示:

(三)实验步骤:
(2)组装好装置,然后应该进行的操作是 。
(3)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入)。仪器A的名称是 ,选择用稀硫酸而不用稀盐酸的好处是 。
(4)先打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶。大约20分钟左右时,观察到饱和食盐水上方有 现象时,再打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。
(四)纯碱制备:
(5)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可作为合成低碳烯烃的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。

已知:H2和CH2=CH2的标准燃烧热分别是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
请回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反应在____________下自发(填“高温”或“低温”),理由是____________。
(3)计算250 ℃时该反应平衡常数的数值K=____________。
(4)下列说法正确的是____________。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
e.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。作出容器内混合气体的平均相对分子质量![]() 随时间变化的图像。
随时间变化的图像。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(俗名草酸)广泛存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,但其钙盐难溶于水。其晶体(H2C2 O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
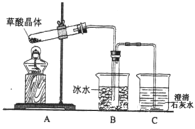
(1)某实验小组同学想通过实验探究草酸晶体的分解产物,设计了右图的装置,其中装置B的主要作用是_____________________。通过观察装置C中的__________________________现象,可以确定草酸晶体分解的产物中有_________________________________。
(2)另一组同学认为草酸晶体分解的产物中不可能只有CO2,从氧化还原反应知识的原理推测可能含有 CO,为了进验证此猜想,该组同学选用了实验中的装置 A、B 和下图所示的部分装置(可以重复选用)进行实验。
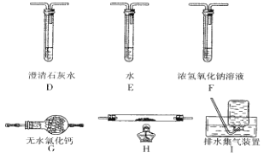
①该组同学的实验装置中,依次连接的合理顺序为 A、B、_______________。装置H反应管中盛有的物质是__________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
(3)设计实验证明草酸的酸性比碳酸的强___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物 的性质叙述正确的是( )。
的性质叙述正确的是( )。
A.1 mol该有机物可以与3 mol Na发生反应
B.1 mol该有机物可以与3 mol NaOH发生反应
C.1 mol该有机物可以与6 mol H2发生加成反应
D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、
CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种离子为 (填化学式);1mol [Fe(CN)6]4-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为﹣20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成.已知小立方体如图所示.该合金的化学式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com