
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
【答案】
(1)ZnO;
(2)浸出;
(3)置换出Fe等;Zn+Fe2+ =Zn2+ +Fe;
(4)O2
(5)2ZnS+4H+ +O2=2Zn2+ +2S↓+2H2O;
(6)在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于Ksp (CuS)小于 Ksp(ZnS),故反应可以发生)。
(7)ZnCO3 +3C![]() Zn+3CO↑
Zn+3CO↑
【解析】
试题分析:(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而除去Fe,反应的离子方程式为Zn+Fe2+=Zn2++Fe;
(4)电解沉积过程中,是电解ZnSO4,阴极锌离子放电生成锌,阳极发生氧化反应,产物为O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)根据沉淀的转化原理可知,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,所以硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS);
(7)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,则化学方程式为ZnCO3+2C![]() Zn+3CO↑。
Zn+3CO↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】


根据实验数据求:
(1)实验完毕后,生成物中水的质量为___g。假设广口瓶里生成一种正盐,其质量为___g。
(2)生成的水中氢元素的质量为____g。
(3)生成的CO2中碳元素的质量为_____g。
(4)气态化石燃料中碳元素与氢元素的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:


请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是____________________
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是____________(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毗氟氯禾灵的合成路线如下:

已知:![]()
(1)B的结构简式为_____________。A的系统名称为_____________。
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有___________(填序号)。
(3)写出反应⑥的化学方程式___________________。
(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式___________________。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由![]() 制备高分子化合物
制备高分子化合物![]() 的合成路线流程图(无机试剂任选),合成流程示意图如下:
的合成路线流程图(无机试剂任选),合成流程示意图如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为

回答下列问题:
(1)A的分子式为 。
(2)A可能发生的化学反应有 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是 mol,燃烧产物的平均摩尔质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,质量为m2。下列说法正确的是( )
A.设锌镀层厚度为h,锌的密度为ρ,则h=(m1-m2)/( ρS)
B.锌电极的电极反应式为 2H2O + 2e- = H2 + 2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁皮,冲洗后用酒精灯加热烘干,铁片可能部分被氧化导致实验结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
![]()
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
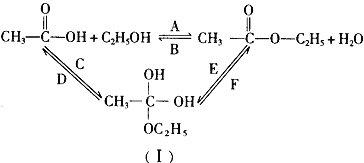
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀镍废水中含有氰根(CN-),其质量浓度往往高于国家排放标准规定的范围,需要进行破氰处理。用化学法处理电镀废水中的氰化物,一般采用碱性氰化法和双氧水氧化法。
I、碱性氯化法是在废水中加入NaOH使Ni2+生成Ni(OH)2沉淀,同时加NaClO将CN-氧化为无毒物质,但此法中ClO-在碱性条件下会和Ni2+反应生Ni(OH)3沉淀和Cl-而大量消耗,反应的离子反应方程式为_______________________________________;
Ⅱ、双氧水氧化法的简易工艺流程如下:

(1)混合反应池中,在碱性条件下H2O2氧化CN-却不会和Ni2+反应,此反应的离子方程式为______________;H2O2还会以质量比为25:2的比例氧化废水中的有机添加剂,降低废水的COD值。
(2)沉淀分离池中,加入焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2,否则会影响沉淀的絮凝沉降,请分析原因________________________________;
(3)向废水中加入30%H2O2(密度为1.11g/mL)的用量为1mL/L,处理前后CN-和有机添加剂的质量浓度如下表所示,若不考虑H2O2的自身分解和溶液体积的变化。请计算需在沉淀分离池中至少加入焦亚硫 酸钠(Na2S2O5)的量为_________g/L(计算结果保留到小数点后两位)。写出计算过程。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:

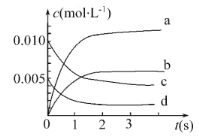
(1)上述反应在第5 s时,NO的转化率为 。
(2)如图中表示NO2变化曲线的是 。用O2表示0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com