
【题目】工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
![]()
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
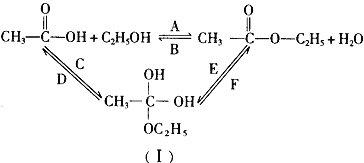
【答案】(10) (1)C2H4+H2O![]() CH3CH2OH
CH3CH2OH
(2)(C6H10O5)n+nH2O![]() nC6H12O6;C6H12O6
nC6H12O6;C6H12O6![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
(3)A、B;C、E;
【解析】
试题分析:(1)乙烯与水在催化剂存在时,在加热条件下发生加成反应产生乙醇,反应的方程式是:CH2=CH2+H2O![]() CH3CH2OH;(2)淀粉水解产生葡萄糖,葡萄糖发酵产生乙醇和CO2,反应的化学方程式是:(C6H10O5)n+nH2O
CH3CH2OH;(2)淀粉水解产生葡萄糖,葡萄糖发酵产生乙醇和CO2,反应的化学方程式是:(C6H10O5)n+nH2O![]() nC6H12O6;C6H12O6
nC6H12O6;C6H12O6![]() 2CH3CH2OH+2CO2↑;(3)A、B是取代反应,C、E是加成反应,D、F是消去反应;所以在A~F 6个反应中,属于取代反应的是A、B;属于加成反应的是C、E。
2CH3CH2OH+2CO2↑;(3)A、B是取代反应,C、E是加成反应,D、F是消去反应;所以在A~F 6个反应中,属于取代反应的是A、B;属于加成反应的是C、E。


科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)F原子基态的外围核外电子排布式为______________________________;
(2)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为_______________;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_______________;
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为_________;

(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2=CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。
①下列说法正确的是__________________;
A.N2O为直线型分子
B.C、N、O的第一电离能依次增大
C.CH2=CH一CHO分子中碳原子均采用sp2杂化
D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H20)5]S04,该配合物中心离子的配体为_____________,其中提供空轨道的是__________________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物克伦特罗(Clenbuterol)结构如下图所示。下列有关克伦特罗的叙述,不正确的是( )

A. 该物质的分子式为C12H18ON2Cl2
B. 该物质易溶于盐酸
C. 该物质的1H核磁共振谱图中有8个吸收峰
D. 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下, K1、K2值如下:

(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g)![]() CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(俗名草酸)广泛存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,但其钙盐难溶于水。其晶体(H2C2 O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
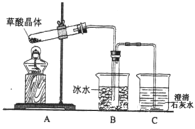
(1)某实验小组同学想通过实验探究草酸晶体的分解产物,设计了右图的装置,其中装置B的主要作用是_____________________。通过观察装置C中的__________________________现象,可以确定草酸晶体分解的产物中有_________________________________。
(2)另一组同学认为草酸晶体分解的产物中不可能只有CO2,从氧化还原反应知识的原理推测可能含有 CO,为了进验证此猜想,该组同学选用了实验中的装置 A、B 和下图所示的部分装置(可以重复选用)进行实验。
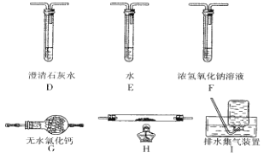
①该组同学的实验装置中,依次连接的合理顺序为 A、B、_______________。装置H反应管中盛有的物质是__________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
(3)设计实验证明草酸的酸性比碳酸的强___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A、B、C均由X、Y、Z三种元素中的两种或三种组成,分子中所含X、Y元素的质量分数及化合物的部分性质列于下表,根据表中有关信息回答下列问题:

(1)由A的密度和沸点可知,A的分子式是_________________。
(2)B是一种烃,则B的分子式是_________________。
(3)根据上述推导结果,计算化合物C的分子式。(书写详细解答过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨ 种元素,填写下列空白:

(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子式是: 。
(3) 最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程 ,该化合物属于 (填“共价”或“离子”)化合物。
(5)元素①的氢化物的电子式为 ,该化合物是由 (填“极性”或“非极性”)键形成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是________。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和 Fe的部分电离能数据如下表:

Mn元素价电子排布式为________,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是___________________________。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于_______区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则 X的化学式为___________。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___________
②与CNO-互为等电子体微粒的化学式为__________(写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com