
【题目】设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下, K1、K2值如下:

(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g)![]() CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)

【答案】
(1)0.05mol/(L·min)
(2)1.5
(3) BC
(4)B
(5)① 增大②不变
(6) A
【解析】
试题分析:(1)反应①Fe(s)+CO2(g)FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)= ![]() ×1mol·L-1=0.5mol·L-1,
×1mol·L-1=0.5mol·L-1,
所以V(CO)为![]() =0.05mol·(L·min)-1;
=0.05mol·(L·min)-1;
(2)①Fe(s)+CO2(g)![]() FeO(s)+CO(g)平衡常数K1;反应②Fe(s)+H2O(g)FeO+H2(g)平衡常数为K2,900℃进行反应③H2(g)+CO2(g)
FeO(s)+CO(g)平衡常数K1;反应②Fe(s)+H2O(g)FeO+H2(g)平衡常数为K2,900℃进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=
H2O(g)+CO(g),其平衡常数K3=![]() =
=![]() =1.50;
=1.50;
(3)由(2)分析知反应②正反应为放热反应,且反应前后气体体积不变;A.缩小反应器体积,增大压强,平衡不移动,故A错误;B.加入水蒸气,反应物的浓度增加,平衡向正反应移动,故B正确;C.该反应为放热反应,降低温度平衡向正反应进行,故C正确;D.使用合适的催化剂,缩短到达平衡时间,平衡不移动.故D错误;故答案为BC;
(4)体积不变的密闭容器中发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g);A.反应达到平衡时,一氧化碳和二氧化碳生成速率相同,v正(CO)=v逆(CO2),故A正确;B.C(CO) = C(CO2)时反应不一定是平衡状态,故B错误;C.反应前后气体体积不变,平衡移动气体质量变化,容器中气体的密度不随时间而变化 说明反应达到平衡,故C正确;D.气体化学计量数变化为0,容器内压强始终不变,不一定是平衡状态,故D错误;答案为AC。
FeO(s)+CO(g);A.反应达到平衡时,一氧化碳和二氧化碳生成速率相同,v正(CO)=v逆(CO2),故A正确;B.C(CO) = C(CO2)时反应不一定是平衡状态,故B错误;C.反应前后气体体积不变,平衡移动气体质量变化,容器中气体的密度不随时间而变化 说明反应达到平衡,故C正确;D.气体化学计量数变化为0,容器内压强始终不变,不一定是平衡状态,故D错误;答案为AC。
(5)①由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,CO2的平衡浓度增大;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变;
(6)由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,且反应①反应前后气体体积不变;A.处于交点时,正逆速率相等,反应处于平衡状态,当温度高于交点温度,平衡向正反应移动,说明图象表示正反应为吸热反应,符合温度变化对反应①的影响,故A正确;B.在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图象表示正反应为放热反应,故B错误;C.到达平衡时间越短,速率越快,温度越高,所以T1>T2,温度越高,CO的含量越低,平衡向逆反应移动,说明图象表示正反应为放热反应,故C错误;故答案为A。


科目:高中化学 来源: 题型:
【题目】下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。

(1)图中属于烷烃的是_________(填字母)。
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成_____和______;不仅可以形成___________,还可以形成碳环。
(3)上图中互为同分异构体的是:A与_________;B与_________;D与_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。

(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)______。
(2)B处发生的化学反应方程式为______ 。
(3)C处应出现的现象是 ,
D处使用碱石灰的作用是 ,
E处应出现的实验现象是 ,
F处可以添加的固体药品是 。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出.由此推断此时B处发生反应的化学方程式为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为

回答下列问题:
(1)A的分子式为 。
(2)A可能发生的化学反应有 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是 mol,燃烧产物的平均摩尔质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是

A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
![]()
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
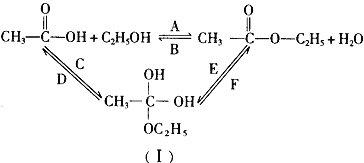
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:

(1)在配制混合酸时应将___________加入到___________中去;
(2)被水浴加热的试管口处都要带一长导管,其作用___________。
(3)该反应的化学方程式是___________;反应类型:___________。
(4)此装置存在几处错误,请修改(可不必填满).①______;②______;
③________。
(5)请从下列操作:①蒸馏;②水洗;③用干燥剂干燥;
④用10%NaOH溶液洗;⑤水洗,选择合适操作,进行分离混酸后的粗产品精制:分液________分液________分液________过滤________。(用序号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶。Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
(1)铬原子核外有______个未成对电子。1mol[Cr(H2O)6]3+中含有δ键的数目是______。
(2)CH3COOH中C原子轨道杂化类型为_________。
(3)CH3CH2OH与H2O可以任意比互溶,是因为_________。
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C_____O(填“>”或“<”)
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该晶体的化学式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com