
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。

(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)______。
(2)B处发生的化学反应方程式为______ 。
(3)C处应出现的现象是 ,
D处使用碱石灰的作用是 ,
E处应出现的实验现象是 ,
F处可以添加的固体药品是 。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出.由此推断此时B处发生反应的化学方程式为______ 。
【答案】
(1)ABEF;
(2)2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)C:白色粉末变为蓝色晶体;D:吸收水蒸气,以防止对后续反应的干扰;E:产生砖红色沉淀;F:高锰酸钾;
(4)CH3CH2OH![]() CH3CHO+H2↑。
CH3CHO+H2↑。
【解析】
试题分析:(1)装置中反应流程是需要制备氧气和乙醇蒸气在加热时反应生成乙醛,通入氢氧化铜中需要加热才会出现砖红色沉淀,所以需要加热的装置有:F是加热制氧气,A需要得到乙醇蒸气需要加热;B处乙醇的催化氧化需要加热;乙醛通入E氢氧化铜溶液需要加热反应生成砖红色沉淀。故答案为:ABEF;
(2)B处的反应是乙醇的催化氧化生成乙醛和水的反应;反应的化学方程式为:2CH3CH2OH+ O2![]() 2CH3CHO+2H2O;(3)乙醇在铜催化作用下被氧气氧化为乙醛和水。C处:白色粉末遇水反应产生硫酸铜晶体,物质由白色变成蓝色晶体;D处使用碱石灰的作用是吸收水蒸气,以防止对后续反应的干扰;E处是乙醛通入新制氢氧化铜中加热反应:产生砖红色沉淀;F处是实验是制氧气,试剂加在大试管中的固体加热生成氧气:实验室制氧气的试剂是:高锰酸钾;(4)去掉制氧气的装置后,E装置中仍然出现砖红色沉淀,说明有乙醛生成,无水硫酸铜不变色说明无水生成,但还有气体不断地逸出.依据原子守恒得到乙醇失去氢反应的氧化反应,化学方程式为:CH3CH2OH
2CH3CHO+2H2O;(3)乙醇在铜催化作用下被氧气氧化为乙醛和水。C处:白色粉末遇水反应产生硫酸铜晶体,物质由白色变成蓝色晶体;D处使用碱石灰的作用是吸收水蒸气,以防止对后续反应的干扰;E处是乙醛通入新制氢氧化铜中加热反应:产生砖红色沉淀;F处是实验是制氧气,试剂加在大试管中的固体加热生成氧气:实验室制氧气的试剂是:高锰酸钾;(4)去掉制氧气的装置后,E装置中仍然出现砖红色沉淀,说明有乙醛生成,无水硫酸铜不变色说明无水生成,但还有气体不断地逸出.依据原子守恒得到乙醇失去氢反应的氧化反应,化学方程式为:CH3CH2OH![]() CH3CHO+H2↑。
CH3CHO+H2↑。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。

已知:室温时Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_____________________________________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是_______________;沉淀A的主要成分是_______________。
(3)热空气吹除时会有部分HS-转变为S2O O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为______________________________________________________。
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是__________,另一离子浓度为______mol/L (当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象________,发生反应的离子方程式___________________。
(5)将足量的SO2气体通入BaCl2溶液中有无明显现象_____________(填“有”或“无”),向NaOH溶液中通入足量的SO2气体,写出所得溶液离子浓度的大小顺序________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列有关溶液中微粒浓度关系的叙述正确的是
A.向0.1mol/LNH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.溶有等物质的量的NaClO、NaHCO5的溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+2c(CO32-)
C.向CH3COONa溶液中滴加稀HCl至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
D.等体积等物质的量浓度CH3COOH溶液和CH3COONa溶液混合:
2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是
A.NH4HCO3溶液中加入足量的NaOH浓溶液:NH4+ + OH- = NH3↑ + H2O
B.向FeBr2溶液中滴加少量氯水:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
C.用电子式表示HCl的形成过程:![]()
D.硫磺在空气中燃烧:2S + 3O2 ![]() 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
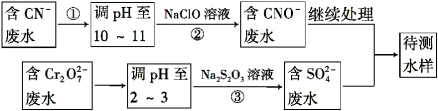
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物克伦特罗(Clenbuterol)结构如下图所示。下列有关克伦特罗的叙述,不正确的是( )

A. 该物质的分子式为C12H18ON2Cl2
B. 该物质易溶于盐酸
C. 该物质的1H核磁共振谱图中有8个吸收峰
D. 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到化学平衡
B. 该反应在T2温度时达到化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下, K1、K2值如下:

(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g)![]() CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A. 若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B. 若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C. 若a>b且c(X-)= c(Y-),则酸性HX>HY
D. 若两溶液等体积混合,则c(Na+)="(a+b)" mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com