
����Ŀ������a mol/L ��NaX��b mol/L��NaY��������Һ������˵����ȷ����
A. ��a=b��c(X��)= c(Y��)+ c(HY)����HXΪǿ��
B. ��a=b��pH(NaX)>pH(NaY),��c(X��)+ c(OH��)> c(Y��)+ c(OH��)
C. ��a>b��c(X��)= c(Y��)��������HX>HY
D. ������Һ�������ϣ���c(Na+)="(a+b)" mol/L(���Ի�Ϲ����е�����仯)
���𰸡�A
�����������������A����a=b����c(X-)=c(Y-)+c(HY)��˵��HX��ȫ���룬������˵��HXΪǿ�ᣬ��A ��ȷ��B����a=b��pH(NaX)��pH(NaY)�����ݵ���غ��c(Na+)+c(H+)=c(X-)+c(OH-)��c(Na+)+c(H+)=c(Y-)+c(OH-)�����������غ��������Һ��c(Na+)��ȣ�������Һ��PH֪��X-��ˮ��̶ȴ���Y-������NaX��������Ũ��С��NaY������c(X-)+c(OH-)��c(Y-)+c(OH-)����B����C����a��b��c(X-)=c(Y-)��˵��X-��ˮ��̶ȴ���Y-���������ˮ��̶�Խ������Ӧ�������Խ����������HX��HY����C����D��������Һ�������ϣ������Ӳ�ˮ�⣬����Һ�������һ����������c(Na+)=![]() mol/L����D����ѡA��
mol/L����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪij��ѧ��ȤС����Ƶ��Ҵ���������ʵ��װ����ͼ�м�������������̨�����еȾ�δ��������ͼ��A�Թ�ʢ����ˮ�Ҵ����е�Ϊ78������B��Ϊ����״��ϸͭ˿��C��Ϊ��ˮ����ͭ��ĩ�������D��ʢ�м�ʯ�ң�EΪ���Ƶ�������ͭ��FΪ�����ķ���װ����

��1����ʵ������У���Ҫ���ȵ��������������У�������������Ĵ���A��F��______��
��2��B�������Ļ�ѧ��Ӧ����ʽΪ______ ��
��3��C��Ӧ���ֵ������� ��
D��ʹ�ü�ʯ�ҵ������� ��
E��Ӧ���ֵ�ʵ�������� ��
F���������ӵĹ���ҩƷ�� ��
��4������ʵ������ȥFװ�ã��������ϸ��ĵ������͵��ܣ���ͬʱ��A�Թܴ�ԭ����˫�������ɵ��������Ա�֤װ�õ������ԣ������������䣬����C�������Ա仯����E��������Ȼ��������3���������ֵ�����֮�⣬�������岻�ϵ��ݳ����ɴ��ƶϴ�ʱB��������Ӧ�Ļ�ѧ����ʽΪ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ���Ũ���ᡢŨ���ᰴ����ͼװ����ȡ���������ش��������⣺

��1�������ƻ����ʱӦ��___________���뵽___________��ȥ��
��2����ˮԡ���ȵ��Թܿڴ���Ҫ��һ�����ܣ�������___________��
��3���÷�Ӧ�Ļ�ѧ����ʽ��___________����Ӧ���ͣ�___________��
��4����װ�ô��ڼ����������ģ��ɲ�������������______����______��
��________��
��5��������в�������������ˮϴ�����ø�������
����10��NaOH��Һϴ����ˮϴ��ѡ����ʲ��������з�������Ĵֲ�Ʒ���ƣ���Һ________��Һ________��Һ________����________��������ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ����(K2Cr2O7)��һ����Ҫ�������������Լ���˾���Ƿ�ƺ��ʻ��Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
��1����ԭ�Ӻ�����______��δ�ɶԵ��ӡ�1mol[Cr(H2O)6]3+�к��Цļ�����Ŀ��______��
��2��CH3COOH��Cԭ�ӹ���ӻ�����Ϊ_________��
��3��CH3CH2OH��H2O��������Ȼ��ܣ�����Ϊ_________��
��4��C��Oλ�����ڱ��еڶ����ڣ���Ƚ����ߵ�һ�����С��C_____O(���������)
��5��Cr��Ca�����γ�һ�־���������Եĸ��������������ͼ��ʾ���þ���Ļ�ѧʽΪ__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������ҪӰ�졣
��1�������Ʊ������á�
�� ��ҵ�ϳɰ��Ļ�ѧ����ʽ�� ��
�� ������������һ��������Ӧ�Ļ�ѧ����ʽ�� ��
��2�����Ķ�����⡣
ˮ���а�����笠�����(ͳ�ư���)�����ļ�ⱸ�ܹ�ע�����ð������������ˮ���а���������ʾ��ͼ���£�
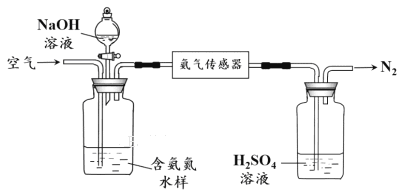
�� ����ƽ��ԭ������������ˮ���м���NaOH��Һ�����ã� ��
�� �����ð�����������1 Lˮ���еİ�����ȫת��ΪN2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ6��10-4 mol ����ˮ���а���(������)����Ϊ mg��L-1��
��3������ת����ȥ����
����ȼ�ϵ��(MFC)��һ���ִ�������ȥ����������ͼΪMFC̼������ͬʱȥ���ĵ�ת��ϵͳԭ��ʾ��ͼ��
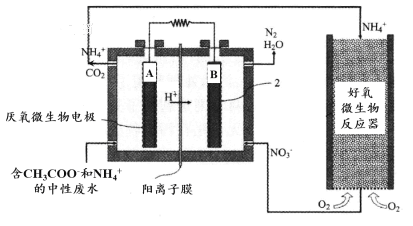
�� ��֪A��B��������CO2��N2��д��A���ĵ缫��Ӧʽ�� ��
�� �û�ѧ�������NH4+ȥ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ����Ҫ�Ļ���ԭ�ϣ�Ҳ����Ҫ�Ĺ�ҵ�ܼ���ʵ�����Ʊ�����ͪ��ԭ�����й����ݼ�װ��ʾ��ͼ���£�
��Ӧԭ���� 
��Ӧ���ȣ��¶ȹ������ظ����ƹ������һ��������
��Ҫ���ϼ����������������
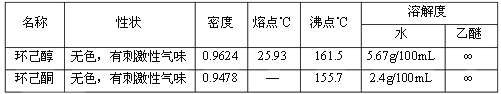
ʵ��װ�ã�

ʵ�鲽�裺
1��Ͷ�ϣ���100mL������ƿ�м���20mLˮ����������5mLŨ����ҡ�������»�������5mL��4.8g��0.048mol�����������������Һ�¶Ƚ���30�����¡���5g��0.019mol���ظ���������ˮ�óȺ�ɫ��Һ���á�
2����Ӧ����Լ1/5���ظ�������Һ����������ƿ�У���ֽ���ʹ֮��Ͼ��ȡ���ˮԡ��ȴ�����Ʒ�Ӧ�¶���55~60�������Ⱥ�ɫ��ʧ���ٽ�ʣ����ظ�������Һ���Ĵμ��뵽������ƿ�С����¶��Զ��½�ʱ������4mL�״�ʹ��ӦҺ��ȫ���ī��ɫ�����۸�����
3�������ڷ�Ӧƿ�м���30mLˮ������Ϊ����װ�ã��ռ�90~99��֮������������ͪ��ˮ�Ĺ���������������Ϊֹ��
4����ȡ����������Һ��ʳ�α��ͺ�ת���Һ©���У��ֳ��л��㡣ˮ����8mL������ȡһ�Σ���������ȡҺ���л���ϲ�������ˮ����þ��� 5�������ռ�����ͪ��Ʒ2.6g�� ��ش��������⣺
��1��װ��A��������___________��
��2����ɲ���ƽ��Ӧ����ʽ��
![]()
��3����Ӧ�����м���״�������ɫ�������ɡ�����״���������___________���������ӷ���ʽ��ʾ��Ӧԭ��___________��
��4������4�����Һ����ʳ�ε�Ŀ����___________����������ȡҺ���л���ϲ���ԭ����___________��
��5���������ò�Ʒ�IJ���___________����������λ��Ч������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����̬��ԭ�ӵļ۵����Ų�ͼΪ
��2����֪TiCl4��ͨ�����������ɫҺ�壬�۵�Ϊ��37�� ���е�Ϊ136�� ����֪TiCl4Ϊ ���壮
��3���������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ��ͼ��ʾ����������Ti��O��ԭ����֮��Ϊ ��
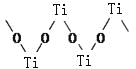
��4��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ���� �����������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ����� ��


��5����C��Mg��Ni����Ԫ����ɵ�һ�ּ������ṹ�Ļ�������г����ԣ��侧����Cλ������λ�ã�Mgλ�ڶ��ǣ�Niռ������λ�ã��û�����Ļ�ѧʽΪ ��������Mgԭ����Χ���������Niԭ���� ���������ͳ������Ͼ�������a=0.38nm������þ�����ܶ� ��gcm��3����������λ��Ч���֣�
��6�������Ѿ����ṹ��ͼ��ʾ������ԭ�ӵİ뾶Ϊr����þ�������ı���ʽΪ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�����ܱ������У��������·�Ӧ��2A(g)��B(g)![]() 2C(g)��D(g)������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0��12 mol/(L��s)����10����ʱ��������B�����ʵ�����
2C(g)��D(g)������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0��12 mol/(L��s)����10����ʱ��������B�����ʵ�����
A. 1��6 mol B. 2��8 mol C. 2��4 mol D. 1��2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B����������֪A�ķ���ʽΪC5Hm����B�����ʽΪC5Hn��m��n��Ϊ������������ش��������⣺
��1�����й�����A����B��˵������ȷ���� ������ţ���
a����A����B���ܻ�Ϊͬϵ��
b����A����B���ܻ�Ϊͬ���칹��
c����m=12ʱ����Aһ��Ϊ����
d����n=11ʱ����B���ܵķ���ʽ��2��
��2������AΪ�������ҷ���������̼ԭ��һ�����棬��һ�������£�1mol A������1mol H2�ӳɣ���A�������� ��
��3������BΪ����ͬϵ�ȡһ��������B��ȫȼ�պ���������ͨ��������Ũ���ᣬŨ�������������1.26g����ͨ�������ļ�ʯ�ң���ʯ�ҵ���������4.4g������B�ķ���ʽΪ �����䱽���ϵ�һ�����ֻ��һ�֣�����ϴ���������B�� �֣�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com