
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
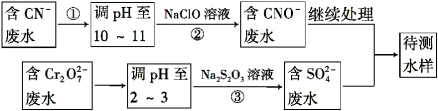
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
【答案】
(1)CN-+H2O![]() HCN+OH-
HCN+OH-
(2)NaCN+H2O2+H2O==NaHCO3+NH3↑
(3)3NaCN+5NaNO2==3CO2↑+4N2↑+4Na2O
(4)①d;②CN-+ClO-==CNO-+Cl- ;③3S2O32- +4Cr2O72- +26H+==6SO42-+8Cr3++13H2O;④D
【解析】
试题分析:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2OHCN+OH-。
故答案为:CN-+H2OHCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑。
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,反应的方程式为
3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O。
故答案为:3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-
的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样。
①从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,需加还原剂还原,故采用方法为氧化-还原法。
故答案为:d;
②步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-。
故答案为:CN-+ClO-═CNO-+Cl-;
③每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
④处理1mol Cr2O72-,需加入a mol FeSO47H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成![]() mol FeⅡ[FexⅢCr(2-x)Ⅲ]O4,根据铁原子守恒得amol=
mol FeⅡ[FexⅢCr(2-x)Ⅲ]O4,根据铁原子守恒得amol=![]() mol①,该反应中得失电子数相等,1mol×2×3=
mol①,该反应中得失电子数相等,1mol×2×3=![]() mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10。
mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10。
故答案为:D。


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
苯酚是一种重要的化工原料。以苯酚为主要起始原料,某种药物中间体的合成路线如下:

已知:![]()
(1)C中含氧官能团的名称为 ;
(2)反应I的反应类型是 ;
(3)反应Ⅱ的化学方程式为 ;
(4)化合物B的名称是 ,E的结构简式为 ;
(5)写出满足下列条件的F的同分异构体的结构简式 (任写两种)。
![]() ①苯环上有三个取代基且苯环上的一氯取代物只有两种.②能与FeCl3溶液发生显色反应.③红外光谱显示有
①苯环上有三个取代基且苯环上的一氯取代物只有两种.②能与FeCl3溶液发生显色反应.③红外光谱显示有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应:

(1)试写出化合物的结构简式:A_____________,E_____________,F_____________。
(2)化学方程式:A→B:______________________________________,
(3)四个反应中,不属于酯化反应的是:A→_________(填化合物对应的字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物,在标准下的密度为0.76 g/L,X、Y、Z三种元素族序数之和为10,Y是地壳中含量最多的金属元素,Y单质能强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)X在周期表中的位置 ;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是 。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为 ,推测这种化合物具有较强的 。(填“氧化性”或“还原性”)
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式: 。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是 。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有 对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的( )
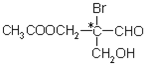
A. 与乙酸发生酯化反应
B. 与NaOH水溶液反应
C. 与银氨溶液作用只发生银镜反应
D. 催化剂作用下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。

(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)______。
(2)B处发生的化学反应方程式为______ 。
(3)C处应出现的现象是 ,
D处使用碱石灰的作用是 ,
E处应出现的实验现象是 ,
F处可以添加的固体药品是 。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出.由此推断此时B处发生反应的化学方程式为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期原子序数依次递增的五种元素A、B、C、D、E。 A、D元素基态原子中成对电子数是未成对电子数的3倍,且D元素基态原子中有6个未成对电子;B的基态原子核外只有7个原子轨道填充了电子,B、C元素基态原子的3p能级上均有1个未成对电子;E元素排在周期表的15列。
(1)B元素基态原子核外电子有_______种运动状态,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______、电子数为_____。
(2)C、E两元素可以形成化合物EC3,此化合物的VSEPR模型为_______,是_______分子(填“极性”、“非极性”)。
(3)写出D基态原子的外围电子排布图____________。
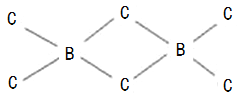
(4)B、C两元素也可以形成共价化合物BC3,但BC3经常以二聚(B2C6)的形式存在,二聚分子具有配位键,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是

A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
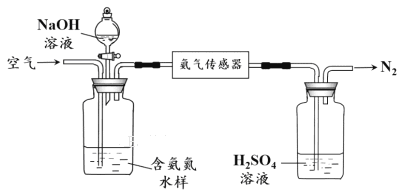
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
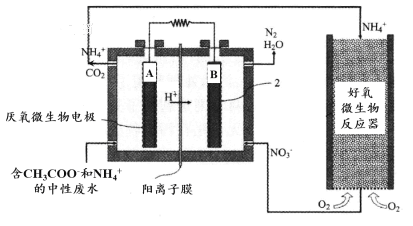
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com