
【题目】化合物A、B、C均由X、Y、Z三种元素中的两种或三种组成,分子中所含X、Y元素的质量分数及化合物的部分性质列于下表,根据表中有关信息回答下列问题:

(1)由A的密度和沸点可知,A的分子式是_________________。
(2)B是一种烃,则B的分子式是_________________。
(3)根据上述推导结果,计算化合物C的分子式。(书写详细解答过程)
【答案】(1)H2O;
(2)C2H6
(3)由上述推导结果可知,X、Y、Z分别为:H、O、C,则 N(C)∶N(H)∶N(O)=![]() ,所以 C 的最简式是CH4O,由于最简式已达饱和,因此D的分子式是CH4O。
,所以 C 的最简式是CH4O,由于最简式已达饱和,因此D的分子式是CH4O。
【解析】试题分析:(1)分析表格数据可以发现A的密度和沸点与水的密度和沸点一致;
(2)根据 M=ρVm=22.4L/mol×1.34g/L=30g/mol,即B分子的相对分子质量为30,B为烃,利用商余法,30÷12=2……6,则该分子的分子式为C2H6。
(3)由上述推导结果可知,X、Y、Z分别为:H、O、C,则 N(C)∶N(H)∶N(O)=![]() ,所以 C 的最简式是CH4O,由于最简式已达饱和,因此D的分子式是CH4O。
,所以 C 的最简式是CH4O,由于最简式已达饱和,因此D的分子式是CH4O。


科目:高中化学 来源: 题型:
【题目】下表列出了A~R 9种元素在周期表中的位置:

(1)F元素的名称为 ;画出B的原子结构示意图: 。
(2)这9种元素中,化学性质最不活泼的是_______;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是 。(填元素符号)
(3)A、D、E三种元素的最高价氧化物形成的晶体中属于分子晶体的是 ,A、B两元素的氧化物中熔点较高的是 ,C、D、F形成的氢化物分子中共价键的极性由强到弱的顺序为 。(填化学式)
(4)工业上用D的一种单质为原料生产E单质粗品的化学方程式为 。
(5)G和H的原子序数相差 。(填数字)
(6)写出一个能证明G比H活泼的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为

回答下列问题:
(1)A的分子式为 。
(2)A可能发生的化学反应有 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是 mol,燃烧产物的平均摩尔质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
![]()
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
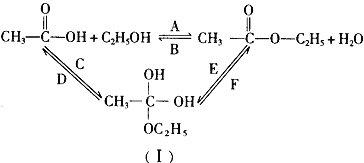
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:

(1)在配制混合酸时应将___________加入到___________中去;
(2)被水浴加热的试管口处都要带一长导管,其作用___________。
(3)该反应的化学方程式是___________;反应类型:___________。
(4)此装置存在几处错误,请修改(可不必填满).①______;②______;
③________。
(5)请从下列操作:①蒸馏;②水洗;③用干燥剂干燥;
④用10%NaOH溶液洗;⑤水洗,选择合适操作,进行分离混酸后的粗产品精制:分液________分液________分液________过滤________。(用序号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀镍废水中含有氰根(CN-),其质量浓度往往高于国家排放标准规定的范围,需要进行破氰处理。用化学法处理电镀废水中的氰化物,一般采用碱性氰化法和双氧水氧化法。
I、碱性氯化法是在废水中加入NaOH使Ni2+生成Ni(OH)2沉淀,同时加NaClO将CN-氧化为无毒物质,但此法中ClO-在碱性条件下会和Ni2+反应生Ni(OH)3沉淀和Cl-而大量消耗,反应的离子反应方程式为_______________________________________;
Ⅱ、双氧水氧化法的简易工艺流程如下:

(1)混合反应池中,在碱性条件下H2O2氧化CN-却不会和Ni2+反应,此反应的离子方程式为______________;H2O2还会以质量比为25:2的比例氧化废水中的有机添加剂,降低废水的COD值。
(2)沉淀分离池中,加入焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2,否则会影响沉淀的絮凝沉降,请分析原因________________________________;
(3)向废水中加入30%H2O2(密度为1.11g/mL)的用量为1mL/L,处理前后CN-和有机添加剂的质量浓度如下表所示,若不考虑H2O2的自身分解和溶液体积的变化。请计算需在沉淀分离池中至少加入焦亚硫 酸钠(Na2S2O5)的量为_________g/L(计算结果保留到小数点后两位)。写出计算过程。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶。Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
(1)铬原子核外有______个未成对电子。1mol[Cr(H2O)6]3+中含有δ键的数目是______。
(2)CH3COOH中C原子轨道杂化类型为_________。
(3)CH3CH2OH与H2O可以任意比互溶,是因为_________。
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C_____O(填“>”或“<”)
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该晶体的化学式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是重要的化工原料,也是重要的工业溶剂。实验室制备环己酮的原理、有关数据及装置示意图如下:
反应原理: 
反应放热,温度过高或者重铬酸钠过量会进一步氧化。
主要物料及产物的物理参数:
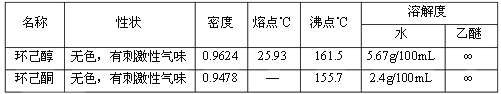
实验装置:

实验步骤:
1.投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下。将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用。
2.反应:将约1/5的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀。冷水浴冷却,控制反应温度在55~60℃。待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中。当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
3.蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90~99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
4.萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层。水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥; 5.蒸馏,收集环己酮产品2.6g。 请回答下列问题:
(1)装置A的名称是___________。
(2)完成并配平反应方程式:
![]()
(3)反应过程中加入甲醇后有无色气体生成。加入甲醇的作用是___________,请用离子方程式表示反应原理___________。
(4)步骤4向馏出液加入食盐的目的是___________,将乙醚提取液和有机层合并的原因是___________。
(5)计算所得产品的产率___________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
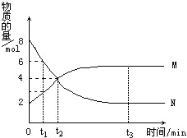
A、反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com