
【题目】钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
【答案】
(1)FeTiO3 + C = Fe + TiO2 + CO
(2)2C+2Cl2+TiO2=2CO+TiCl4
(3)Cu+VOCl3=CuCl+VOCl2
(4)防止Mg在高温下与空气中O2、CO2等反应 ,①加入过量的稀盐酸②过滤③洗涤、干燥固体。
(5) TiO2+4e—=Ti+2O2—
【解析】
试题分析:钛铁矿在高温条件下被碳还原,得到生铁和高钛渣(TiO2),高钛渣与碳、氯气高温条件下生成TiCl4,TiCl4用镁还原可知海绵钛,
(1)FeTiO3高温下与等物质的量的碳还原出铁同时生成二氧化钛,反应的化学方程式为FeTiO3+C![]() Fe+TiO2+CO;
Fe+TiO2+CO;
(2)氯化反应是碳、氯气与二氧化钛的反应,根据元素守恒可知,过程中会产生一种无色可燃性气体应为CO,反应的化学方程式为2C+2Cl2+TiO2![]() 2CO+TiCl4;
2CO+TiCl4;
(3)在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物应为VOCl2,反应的化学方程式为Cu+VOCl3![]() CuCl+VOCl2;
CuCl+VOCl2;
(4)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应,所以反应过程中通入氩气的目的是防止Mg在高温下与空气中O2、CO2等反应,金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,所以实验操作为①加入过量的稀盐酸②过滤③洗涤、干燥固体;
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO2等。


科目:高中化学 来源: 题型:
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白:
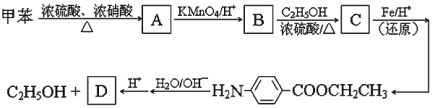
⑴ 写出化合物 B 的结构简式: 。
⑵ 由 B 到 C 的反应类型是 。
⑶ 任意写出两种同时符合下列要求的化合物 C 的同分异构体的结构简式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基;
② 分子中含有 -COO- 结构的基团。
![]()
![]()
![]()
⑷ E、F、G 中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是 (在 E、F、G 中选择,填字母)。
⑸ 一定条件下,化合物 D 发生聚合反应的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可作为合成低碳烯烃的原料加以利用。如:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。
CH2=CH2(g)+4H2O(g) ΔH= a kJ·mol-1如图所示为在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响。

已知:H2和CH2=CH2的标准燃烧热分别是-285.8 kJ·mol-1和-1411.0 kJ·mol-1。H2O(g) ![]() H2O(l) ΔH=-44 kJ·mol-1
H2O(l) ΔH=-44 kJ·mol-1
请回答:
(1)a=__________kJ·mol-1。
(2)上述由CO2合成CH2=CH2的反应在____________下自发(填“高温”或“低温”),理由是____________。
(3)计算250 ℃时该反应平衡常数的数值K=____________。
(4)下列说法正确的是____________。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250℃时CO2的平衡转化率可能位于点M2
e.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。作出容器内混合气体的平均相对分子质量![]() 随时间变化的图像。
随时间变化的图像。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物 的性质叙述正确的是( )。
的性质叙述正确的是( )。
A.1 mol该有机物可以与3 mol Na发生反应
B.1 mol该有机物可以与3 mol NaOH发生反应
C.1 mol该有机物可以与6 mol H2发生加成反应
D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。下列有关该电池的说法正确的是( )

A.铜片上的电极反应:Cu2++2e﹣=Cu
B.电子通过溶液由锌片流向铜片
C.电池工作时电能直接转化为化学能
D.该电池工作时,若有16.25gZn被溶解,导线中转移0.50mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期主族元素的性质或原子结构如下表:

(1)元素Y在周期表中的位置_________(周期、族)。
(2)XN2的电子式是:_________,Y的简单氢化物的结构式_________。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________。
(4)用电子式表示WZ的形成过程_________。
(5)元素Z和T相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________。
A.常温下Z单质和T单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式_________,所得溶液的溶质是_________化合物(填“离子”或“共价”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com