
【题目】(1)请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
①负极材料为:__________发生的电极反应是: ,电流__________(填“流出”或“流入”)
②正极发生的电极反应是: ,该反应为 (填“氧化反应”或“还原反应”) 。
③若电路中转移6.02×1022个e﹣,则产生标况下H2的体积为_____ _____。
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号) 。

【答案】(1)①Fe;Fe﹣2e﹣═Fe2+;流出; ②2H++2e﹣═H2↑;还原反应;③1.12L
(2)Ⅱ<Ⅲ<Ⅰ
【解析】
试题分析:(1)①根据方程式Fe+2H+=Fe2++H2↑可知铁失去电子作还原剂,则负极材料为Fe,发生的电极反应是Fe﹣2e﹣═Fe2+;原电池中电流从正极流出;
②原电池中正极发生得到电子的还原反应,则正极是溶液中的氢离子放电,发生的电极反应是2H++2e﹣═H2↑,该反应为还原反应。
③若电路中转移6.02×1022个e﹣,电子的物质的量是0.1mol,则产生标况下H2的体积为![]() =1.12L。
=1.12L。
(2)处于Ⅰ时铁和碳构成原电池,铁是负极,加快腐蚀;处于Ⅱ时铁和锌构成原电池,铁是正极,被保护;处于Ⅲ时铁发生化学腐蚀,因此三种不同的环境中则铁被腐蚀的速率由慢到快的顺序是Ⅱ<Ⅲ<Ⅰ。


科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠。(1)写出相关离子方程式 。
(二)实验装置:所需实验药品和装置如下图所示:

(三)实验步骤:
(2)组装好装置,然后应该进行的操作是 。
(3)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入)。仪器A的名称是 ,选择用稀硫酸而不用稀盐酸的好处是 。
(4)先打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶。大约20分钟左右时,观察到饱和食盐水上方有 现象时,再打开 (填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体。
(四)纯碱制备:
(5)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(俗名草酸)广泛存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,但其钙盐难溶于水。其晶体(H2C2 O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
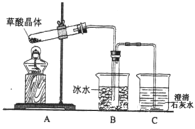
(1)某实验小组同学想通过实验探究草酸晶体的分解产物,设计了右图的装置,其中装置B的主要作用是_____________________。通过观察装置C中的__________________________现象,可以确定草酸晶体分解的产物中有_________________________________。
(2)另一组同学认为草酸晶体分解的产物中不可能只有CO2,从氧化还原反应知识的原理推测可能含有 CO,为了进验证此猜想,该组同学选用了实验中的装置 A、B 和下图所示的部分装置(可以重复选用)进行实验。
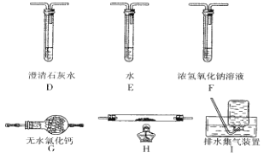
①该组同学的实验装置中,依次连接的合理顺序为 A、B、_______________。装置H反应管中盛有的物质是__________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
(3)设计实验证明草酸的酸性比碳酸的强___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物 的性质叙述正确的是( )。
的性质叙述正确的是( )。
A.1 mol该有机物可以与3 mol Na发生反应
B.1 mol该有机物可以与3 mol NaOH发生反应
C.1 mol该有机物可以与6 mol H2发生加成反应
D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨ 种元素,填写下列空白:

(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子式是: 。
(3) 最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程 ,该化合物属于 (填“共价”或“离子”)化合物。
(5)元素①的氢化物的电子式为 ,该化合物是由 (填“极性”或“非极性”)键形成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某优质甜樱桃中含有一种羟基酸(用M表示),M的碳链结构无支链,分子式为C4H6O5;1.34 g M与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。M在一定条件下可发生如下转化:M![]() A
A![]() B
B![]() C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
A. M的结构简式为HOOC—CHOH—CH2—COOH
B. B的分子式为C4H4O4Br2
C. 与M的官能团种类、数量完全相同的同分异构体还有1种
D. C物质不可能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、
CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种离子为 (填化学式);1mol [Fe(CN)6]4-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为﹣20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成.已知小立方体如图所示.该合金的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
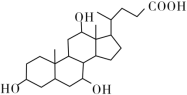
X(C24H40O5)
H2NCH2CH2CH2NHCH2CH2CH2CH2NH2 Y
下列叙述错误的是 ( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com