
【题目】下列反应中符合下图图象的是( )

A. N2(g) +3H2(g)![]() 2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0)
2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0)
2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0)
4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0)
D. H2(g) +CO(g)![]() C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0)
C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0)
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取到的酸性物质,其结构如下图所示。下列叙述正确的是

A. 迷迭香酸属于芳香烃 B. 1 mol 迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应 D. 1 mol 迷迭香酸最多能和含5 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前国际空间站处理CO2废气涉及的反应为CO2+4H2![]() CH4+2H2O,该反应的下列说法正确的是( )
CH4+2H2O,该反应的下列说法正确的是( )
A. 达到平衡时,H2与CH4的体积之比为4 : l
B. 升高温度能减慢该反应的速率
C. 当断裂4molH-H键同时断裂4molO-H键,该反应达到平衡状态。
D. 当4V正(H2) = V逆(CH4) 时,该反应达到平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是_____________(填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是___________(填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是____________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________________。
③ V1和V2的关系:V1___________V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)=_____mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较________(填溶质的化学式)溶液中NH![]() 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是( )
A. 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用左手压住分液漏斗上口部,右手握住活塞部分,把分液漏斗倒转过来振荡
B. 静置,分液漏斗中溶液分层,下层呈紫红色,上层几乎无色
C. 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D. 最后继续打开活塞用另一个烧杯承接上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是( )

A. 0~a间发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.480mL,56.2g
B.500mL,56.2g
C.500mL,58.5g
D.任意规格,56.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )
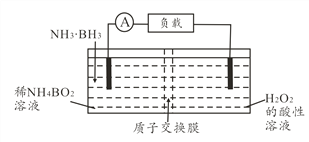
A. 左侧电极发生还原反应
B. 电池工作时,H+通过质子交换膜向负极移动
C. 正极的电极反应式为2H++2e-=H2↑
D. 消耗3.1g氨硼烷,理论上转移0.6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com