
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�Mg0��ʵ�鷽����������
��֪��Kap[Mg(OH)4]=5.61��10-12 ����˵����ȷ���ǣ������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2011?�㽭����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����
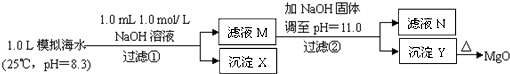 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������ʡ������У������һ��������11�£����ۻ�ѧ�Ծ��������棩 ���ͣ������
��ˮ�к��зḻ��þ��Դ����ҵ�ϳ��ú�ˮɹ�κ�Ŀ�±ˮ��ȡMg����������ͼ��ʾ��

��1����ҵ��ȡþ�ķ����� ����
��2���Լ���һ��ѡ�� ���ѧʽ����
��3����ͼ�ǽ���þ��±�ط�Ӧ�������仯ͼ(��Ӧ��Ͳ����Ϊ298Kʱ���ȶ�״̬)��

����ͼ��֪Mg��±�ص��ʵķ�Ӧ��Ϊ ������ȡ������ȡ�����Ӧ���Ʋ⻯��������ȶ���˳��ΪMgI2 MgF2�����������������������
������ͼ����д��MgBr2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽ ��
��4������Mg��CH3Cl��һ�������·�Ӧ������CH3MgCl��CH3MgCl��һ����Ҫ���л��ϳ��Լ�������ˮ����ˮ�ⷴӦ������ɫ��ζ�������ɡ�д��CH3MgClˮ��Ļ�ѧ����ʽ ��
��5����Mg(OH)2�м���NH4Cl��Һ����ʹ�����ܽ⣬����ƽ��ԭ���ͱ�Ҫ�����ֽ���ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡ�����ڶ����¿���ѧ�Ծ� ���ͣ�ѡ����
��ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����

ע����Һ��ij�����ӵ�Ũ��С��1.0��10-5mo1/L������Ϊ�����Ӳ����ڣ�
��֪��Ksp��CaCO3��= 4��96��10-9; Ksp��MgCO3��= 6��82�� 10-6;
Ksp[Ca��OH��2]=4��68��l0-6; Ksp[Mg��OH��2]=5��61��l0-12��
����˵����ȷ���ǣ�����ʵ���������Һ������䣩 �� ��
A��������XΪCaCO3
B����ҺM�д���Mg2+��������Ca2+
C����ҺN�д���Mg2+��Ca2+
D�������������Ϊ����4��2 g NaOH���壬������YΪCa��OH��2��Mg��OH��2�Ļ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com