
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、醋酸溶液除水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ |
| D、向NaAlO2溶液中滴加NaHCO3溶液HCO3-+AlO2-+H2O=A(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中. | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+. |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有一个双键的直链有机物 |
| B、含有两个双键的直链有机物 |
| C、含有一个双键的环状有机物 |
| D、含有两个环的环状有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
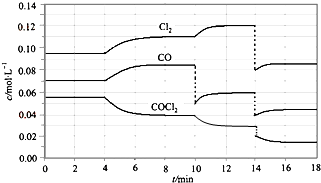 光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )
光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )| A、从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol?L-1?min-1 |
| B、第8 min时与第18 min时反应的平衡常数相同 |
| C、由于10 min时条件的改变,使COCl2的转化率降低 |
| D、在第14 min时,改变的条件可能是压缩反应容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径Z>Y |
| B、同周期元素中Y的金属性最强 |
| C、同主族元素中X的氢化物稳定性最高 |
| D、同周期元素中Z的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
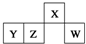 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入少量SO2,溶液的漂白性增强 | ||
| B、加入少量Na2CO3粉末或CaCO3粉末,c(H+)减小,HClO浓度增大 | ||
| C、加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-) | ||
D、再加入少量水,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、5:1 |
| C、1:5 | D、3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com