
A.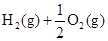 ══ ══  |
B. ══ ══  |
C. ══2CO2(g)+2H2O(l) ══2CO2(g)+2H2O(l) |
D. ══ ══  |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
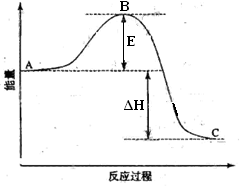
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
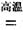 TiCl4+2CO
TiCl4+2CO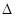 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1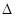 H=-566 kJ·mol-1
H=-566 kJ·mol-1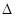 H=+141 kJ·mol-1
H=+141 kJ·mol-1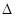 H= ,
H= ,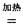 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。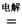 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 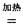 2MgCl2+Ti
2MgCl2+Ti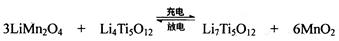 ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.书写热化学方程式时不但要注明反应物和生成物的状态,还需要注明反应环境的温度和压强 |
| B.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol |
| C.同一化学反应化学计量数不同,△H值不同,化学计量数相同而状态不同,△H值也不相同 |
| D.相同条件下,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2; 则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ |
| D.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
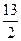 O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com