
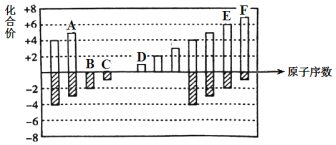
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
(1)E在元素周期表中的位置是_________。
(2)C、D、F原子半径由大到小的顺序是____________(填元素符号)。
(3)A、B、C的单质与氢气反应剧烈程度由强到弱的顺序____________.(用单质的化学 式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E形成的化合物的化学式_________、________(写2种)。
(5)判断F的单质和E的最简单氢化物之间能否发生反应,若能则写出反应的化学方程式,若不能则说明理由________
【答案】第3周期VIA族 Na>Cl>F F2>O2>N2 Na2S Na2S2等 Cl2+H2S= S+2HCl
【解析】
由图知A、B、C、D、E、F的原子序数依次增大,其中B的化合价为-2价,E的化合价为-2、+6价,则B、E同主族,分别为氧元素、硫元素,C的化合价为-1价,F的化合价为-1、+7价,则C、F同主族,分别为氟元素、氯元素,A的化合价为-3、+5价,则A为氮元素、D的化合价为+1价,则D为钠元素,综上,A为氮、B为氧、C为氟、D为钠、E为硫、F为氯,据此回答;
(1)E为硫,在元素周期表中的位置是第3周期VIA族;答案为:第3周期VIA族;
(2)C、D、F分别为氟、钠、氯, Na和Cl位于同周期,钠原子半径大,F和Cl位于同主族,氯原子半径大,则原子半径由大到小的顺序是Na>Cl>F;答案为:Na>Cl>F;
(3) A为氮、B为氧、C为氟,非金属性F>O>N,元素的非金属性越强,它的单质越容易与氢气反应形成气态氢化物,反应越剧烈,则A、B、C的单质与氢气反应剧烈程度由强到弱的顺序为:F2>O2>N2;答案为:F2>O2>N2;
(4) D为钠、E为硫,D和E形成的化合物的化学式为:Na2S;Na2S2等;答案为:Na2S;Na2S2等;
(5) E为硫、F为氯,非金属性Cl>S,则 F的单质和E的最简单氢化物之间即Cl2+H2S能发生反应化学方程式为:Cl2+H2S= S+2HCl。答案为:Cl2+H2S= S+2HCl。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.23gNa与氧气充分反应,生成Na2O和Na2O2的混合物,转移的电子数为大于NA小于2NA
B.0.5mol甲醇中含有的共价键数为2.5NA
C.标准状况下,0.25molHF的体积为5.6L
D.0.2mol/L的Na2SO4溶液中含Na+ 数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应的离子方程式,或根据离子方程式,写一个符合条件的化学方程式。
①碳酸镁和足量稀盐酸反应______________________。
②碳酸氢钠与硫酸反应__________________________。
③MnO2+4HCl![]() MnCl2+Cl2↑ +2H2O_____________________。
MnCl2+Cl2↑ +2H2O_____________________。
④Zn+2Ag+=Zn2++2Ag _______________________。
⑤CO32- + 2H+=H2O + CO2↑_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组设计了如下图所示的实验装置用于制备ClO2。
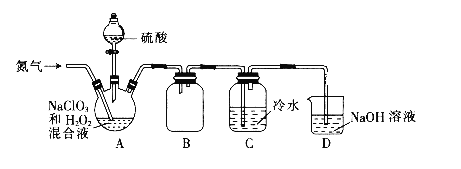
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________。
②装置B的作用是_________。
③当看到装置C中导管液面上升时应进行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3标准液测定装置C中ClO2溶液的浓度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
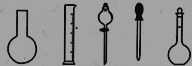
①配制0.1000molL-1的Na2S2O3标准溶液时所需仪器除在如图所示的仪器中进行选择外,还需用到的玻璃仪器是________(填仪器名称)
②在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
③取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示剂,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机金属化合物的应用研究是目前科学研究的前沿之一。二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
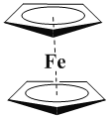

环戊二烯二茂铁
(1)环戊二烯分子中σ键和π键的个数比为___。
(2)下列关于环戊二烯和二茂铁的说法不正确的是__(填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___。
(4)已知环戊二烯阴离子(C5H5-)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___(填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:
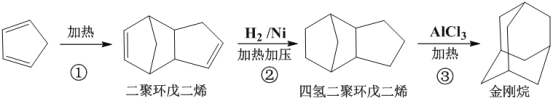
①金刚烷的分子式为____,反应①的反应类型是___。
②金刚烷的二氯代物有__种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出符合下列条件的二聚环戊二烯的同分异构体的结构简式___。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
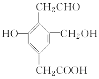
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是
中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是![]()
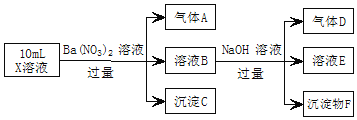
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com