
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
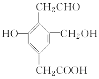
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题.
(1)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为H2SO4溶液),通过装置Ⅱ实现铁棒镀铜。

①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是___________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度_______;
③若实验过程中Ⅱ中的铜片质量减少了2.56g,则Ⅰ中理论上消耗CH4的体积(标准状况)______L。
(2)若将装置Ⅱ中的两电极均改为石墨惰性电极:
①写出装置Ⅱ中发生的总化学反应方式________________________________。
②若用Ⅱ电解200 mL 0.05 mol·L-1的CuSO4溶液,一段时间后溶液中的Cu2+恰好完全析出,恢复至室温,溶液pH=__________(忽略电解过程中溶液体积变化);若想将上述电解后的溶液恢复为与电解前的溶液相同,可以加入一定质量的__________(填序号);
a.Cu b.CuO c.Cu(OH)2 d.CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____。
CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和___(填化学式),由此可以推知CN22-的空间构型为___。
(2)尿素分子中C原子采取____杂化。尿素分子的结构简式是____。
(3)三聚氰胺 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过____结合,在肾脏内易形成结石。
(4)H2与O2发生反应的过程用模型图示如下(“—”表示化学键):

其中过程Ⅰ是___过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的_______分子(填“极性”或“非极性”)。
(5)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_____。

已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离_____(列出计算式)CaO晶体和NaCl晶体的晶格能分别为:CaO3401kJ·mol-1、NaCl786kJ·mol-1。导致两者晶格能差异的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是

A. 用图a所示装置配制100mL0.100mol·L-1稀盐酸
B. 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C. 用图c所示装置制取少量CO2气体
D. 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
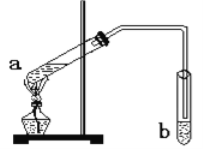
(1)写出试管a中发生的化学方程式:_____________________________________;
(2)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是 ________________;
(3)浓硫酸的作用为___________________________________________________;
(4)试管b中所盛的溶液为________________,其主要作用是 _________________________。
(5)分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行:
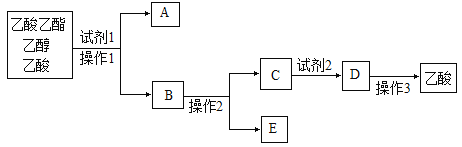
①试剂1最好选用_________________,
②操作1是________________,所用的主要仪器名称是_______________;
③操作2是_____________,试剂2最好选用_______________,操作3是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为44%,则氢元素的质量分数为( )
A. 48%B. 8%C. 56%D. 10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL的FeBr2溶液中通入标准状况下的C12 3.36 L后,C12全部被还原,并且测得溶液中c(Br–)=c(Cl–),则原FeBr2溶液的物质的量浓度是
A.3mol/LB.2mol/ LC.1.5 mol/ LD.0.75mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com