
����Ŀ��������ĿǰӦ����㷺�Ľ������ϣ��˽������ʴ��ԭ�����������������Ҫ���壬�Ը�����Ʒ���п���ʴ���������ʵ��ӳ���ʹ��������
��1������ʴ����ǰ�������г��������������⡣�ֽ�һ����������������������У��������������Һ�з����Ļ��Ϸ�Ӧ�Ļ�ѧ����ʽΪ��________________________��
��2������ͼװ�ã�����ģ�����ĵ绯ѧ������

����XΪ̼����Ϊ���������ĸ�ʴ������KӦ����________����
����XΪп������K����M�����õ绯ѧ��������Ϊ________��
��3����ͼ����XΪ��ͭ�������к�ˮ�滻Ϊ����ͭ��Һ������K����N����һ��ʱ���������������3.2 gʱ��X�缫�ܽ��ͭ������________3.2 g(�<����>������)�����������ͭ����Ч��ֹ������ʴ�������������δ����ͭ����Ʋ����𣬶�ͭ���ȶ�п���������ױ���ʴ�����Ҫ˵��ԭ��_________________________________________________��
���𰸡�2FeCl3��Fe===3FeCl2 N ��������������������(����������������) < �ڳ�ʪ�Ļ����й���ԭ��أ����Ǹ��������ٸ�ʴ
��������
��1���������������Һ�з����ķ�Ӧ���������ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ�������
��2������������̼�Ͻ𣬿���K�Ͽ�ʱ��������������̼����ˮ����ԭ��أ���Ҫ����������ʴ����XΪ̼��������K����M����������̼������ˮ����ԭ��أ�����Ϊ��������ʴ��������K����N����������̼������ˮ���ɵ��أ�����Ϊ������������
����XΪп������K����M������������п������ˮ����ԭ��أ�пΪ��������ʴ��������������
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N�������ɵ��أ���ͭ��ͭ��п����ʧ�������������ӣ������缫ֻ��ͭ���ӵõ������ɵ���ͭ���ڳ�ʪ�Ļ����У���ͭ���Ʋ�����ԭ��أ�������������ʴ����п���Ʋ�����ԭ��أ�п����������ʴ������������������
��1���������������Һ�з����ķ�Ӧ���������ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ����������ڻ��Ϸ�Ӧ�ķ���ʽ��2FeCl3��Fe=3FeCl2���ʴ�Ϊ��2FeCl3��Fe=3FeCl2��
��2������������̼�Ͻ𣬿���K�Ͽ�ʱ������������̼����ˮ����ԭ��أ���Ҫ����������ʴ����XΪ̼��������K����M����������̼������ˮ����ԭ��أ�����Ϊ��������ʴ��������K����N����������̼������ˮ���ɵ��أ�����Ϊ����������������Ϊ���������ĸ�ʴ������KӦ����N�����ʴ�Ϊ��N��
����XΪп������K����M������������п������ˮ����ԭ��أ�пΪ��������ʴ���������������õ绯ѧ��������Ϊ��������������������(����������������)���ʴ�Ϊ����������������������(����������������)��
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N�������ɵ��أ�X�缫ͭ��п��ʧ�������������ӣ������缫ֻ��ͭ���ӵõ������ɵ���ͭ�����ݵ����غ㣬��������������3.2gʱ��X�缫�ܽ��ͭ������<3.2 g���ڳ�ʪ�Ļ����ж�ͭ���Ʋ�����ԭ��أ�������������ʴ����п���Ʋ�����ԭ��أ�п����������ʴ�������������������ʴ�Ϊ��<���ڳ�ʪ�Ļ����й���ԭ��أ����Ǹ��������ٸ�ʴ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ�����������Լ������м�ȩ�ĺ������ô�������ԭ��
��ͼ��ʾ��

��1����װ�õ���Ҫ����ת����ʽ��_______________��bΪ______���������ĵ缫��ӦʽΪ_________________��
��2���ڴ��������������У��������Һ�����Ũ��___________���������С�������䡱��������·��ת��0.2 mol����ʱ���������ڲμӷ�Ӧ��HCHOΪ_______g��
������ͼװ�õ���������Һ����ȡ������������������������أ������ڵ������ӽ���Ĥֻ����������ͨ���������ӽ���Ĥֻ����������ͨ������

��1���õ��۵���������_____��Ӧ�������������ԭ������
��2���Ƶõ�������Һ�ӳ���_______���A������D����������������ԭ��________________________________________________�����û�ѧ��������ֽ��ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.2mol/LһԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����

A. HA��ǿ��
B. �û��ҺpH=7
C. ͼ��x��ʾHA��Y��ʾOH-��Z��ʾH+
D. �û����Һ�У�c(A-)+c(Y)=c��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��0.4 molij��������Ϊ9.8 L����������Ħ�����Ϊ____________��
��2���б�״���µ���������:��6.72 L CH4����3.01��1023��H2���ӣ���3.4 g H2S����0.2 mol NH3������������Ӵ�С��˳��Ϊ:_________________������ţ���
��3����״���£����1.92��ij��������Ϊ672 mL������������Է�������Ϊ__________
��4��ʵ������Na2CO3��10H2O��������0.5mol/L��Na2CO3��Һ970mL��Ӧ��ȡNa2CO3��10H2O��������___________��
��5��ijѧ������12mol��L��1Ũ���������ˮ����500 mL 0.3 mol��L��1��ϡ���ᡣ
����ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
������ʵ������ᵼ�������Ƶ�ϡ��������ʵ���Ũ��ƫС����__________������ţ���
a.����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��
b.����ȡŨ�������Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
c.ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
d. ���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
e.����ƿϴ�Ӹɾ���δ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���������¸�װ�����ӳ�һ����װ�ã�̽�������백��֮��ķ�Ӧ������D Ϊ��������������봿�����ﰱ����Ӧ��װ�á�

��ش��������⣺
(1)���Ӻ�װ�ú�����е�һ��ʵ�������_____
(2)װ��E ��������_____���� k ��������_____
(3)װ��F ���Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ _____
(4)װ��D �ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�����ǿ�������Ҫ�ɷ�֮һ��д���÷�Ӧ�Ļ�ѧ����ʽ_____
(5)����D װ�õ�����������߽ϳ����ұ߽϶̣�Ŀ����_____
(6)����װ�ô������ҵ�����˳����(j)��______��______��(f) (g)��______ ��______��______ ��______��(a)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ �����й��ڸ��л�����ӽṹ��˵������ȷ����
�����й��ڸ��л�����ӽṹ��˵������ȷ����
A. �����18��ԭ����ͬһƽ���� B. �����4��̼ԭ����һ��ֱ����
C. �����12��̼ԭ����ͬһƽ���� D. ����ԭ�Ӷ�������ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Һ�д��ڵ���ƽ��HA![]() H++A����������������ȷ���ǣ�
H++A����������������ȷ���ǣ�
A. ��Һ������Ũ�ȵĹ�ϵ���㣺c(H��) = c(OH��)��c(A��)
B. �����£�����NaA�����ʹHA�ĵ��볣������
C. HA��Һ�м�������NaA���壬ƽ�������ƶ�
D. 0.10mol/L��HA��Һ�м�ˮϡ�ͣ���Һ��c(OH��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ��Na��NaOH��NaHCO3�ֱ�������ʵ����ĸ�����ǡ�÷�Ӧʱ��Na��NaOH��NaHCO3�����ʵ���֮��Ϊ(����)
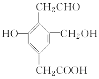
A. 3��3��2B. 3��2��1
C. 1��1��1D. 3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ϳɳ��ݼ������ɺ�Ⱦ���м���X��

��֪��Ϣ��

��1������˵����ȷ����___��
A��������B��C��ת���漰��ȡ����Ӧ B��������C��������
C���Լ�D�����Ǽ״� D�������ɵķ���ʽ��C10H10N2O3S
��2��������F�Ľṹ��ʽ��________��
��3�� д��E+G��H�Ļ�ѧ����ʽ______��
��4��д������ʽΪC6H13NO2��ͬʱ��������������ͬ���칹��Ľṹ��ʽ��д��2������_____��
�ٷ�������һ����Ԫ�����ҳɻ�ԭ������ຬ2����̼ԭ�ӣ�
��1H��NMR��IR��������������4�ֻ�ѧ������ͬ����ԭ�ӡ���N��O����û�й���������O��O������
��5�������CH3CH2OH�� Ϊԭ���Ʊ�X��
Ϊԭ���Ʊ�X�� ���ĺϳ�·�ߣ����Լ���ѡ���ϳ������õ������٢�������֪��Ϣ��������ͼ��ʾ����_____
���ĺϳ�·�ߣ����Լ���ѡ���ϳ������õ������٢�������֪��Ϣ��������ͼ��ʾ����_____
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com