
【题目】Ⅰ.通过传感器可以监测空气中甲醛的含量。该传感器的原理
如图所示:

(1)该装置的主要能量转化形式是_______________。b为______极,发生的电极反应式为_________________。
(2)在传感器工作过程中,电解质溶液硫酸的浓度___________(填“增大”“减小”“不变”)。当电路中转移0.2 mol电子时,传感器内参加反应的HCHO为_______g。
Ⅱ.用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。

(1)该电解槽的阴极发生_____反应(填“氧化”“还原”)。
(2)制得的硫酸溶液从出口_______(填“A”、“D”)导出,并简述原因________________________________________________(请用化学用语和文字解释)。
【答案】化学能转化为电能 负 HCHO+H2O-4e-==CO2+4H+ 减小 1.5 还原 A 2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大,SO42-通过阴离子交换膜进入阳极,和H+组成硫酸
【解析】
Ⅰ.原电池工作时,HCHO失电子在负极发生氧化反应,负极反应为HCHO+H2O-4e-=CO2+4H+,O2在正极得电子发生还原反应,正极反应为O2+4e-+4H+=2H2O,结合电池总反应判断溶液浓度变化,以此解答该题;
Ⅱ.(1)电解池的阴极发生还原反应,阳极上发生氧化反应;(2)阳极附近溶液中氢氧根离子失去电子生成氧气,附近水的电离平衡被破坏,氢离子浓度增大,A处是硫酸。
Ⅰ.(1)该装置无外接电源,应为原电池,能量转化形式为将化学能转化为电能;其中b极HCHO发生氧化反应生成CO2,应为原电池的负极,电极反应为HCHO+H2O-4e-==CO2+4H+;(2)该原电池的a极为正极,发生电极反应为O2+4e-+4H+=2H2O,原电池工作时有水生成,则电解质溶液硫酸的浓度会减小;由负极电极反应为HCHO+H2O-4e-==CO2+4H+可知,当电路中转移0.2 mol电子时,参加反应的HCHO的物质的量为0.05mol,质量为0.05mol×30g/mol=1.5g。
Ⅱ.(1)电解硫酸钾溶液,电解池中阴极上是溶液中氢离子得电子发生还原反应生成氢气;(2)OH-在阳极放电,发生氧化反应生成氧气,使水的电离平衡正向移动,电极反应式为2H2O-4e-=4H++O2↑,则阳极区c(H+)增大,SO42-通过阴离子交换膜进入阳极,和H+组成硫酸,故A处是硫酸。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
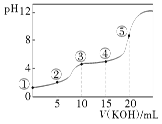
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g)![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:HClO:Ka=3.0×10ˉ8;H2CO3:Ka1=4.30×10ˉ7;Ka2=5.61×10ˉ11)
(3)已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填“<”或“>”);若900℃时,另做一组实验,在此容器中加入10molCO,5mo1H2O,2mo1CO2,5molH2,此时v(正) ___v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应为Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法不正确的是(已知阴离子交换膜的作用是只允许阴离子通过)( )
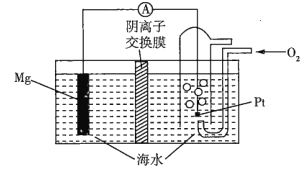
A.通入氧气的电极为正极
B.放电时,溶液中的OH-移向负极
C.负极的电极反应式为Mg-2e-+2OH-=Mg(OH)2
D.当电路中转移0.04mol电子时,参加反应的O2为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质![]() 分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。


①若如图1所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,![]() 是________(填两种物质的化学式)。
是________(填两种物质的化学式)。
②若如图2所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是________(填序号)。
A ![]() 还原
还原![]() 的反应 B
的反应 B ![]() 的分解反应 C
的分解反应 C ![]() 和
和![]() 的反应
的反应
(2)如图3所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块铝片,再滴入![]() 稀
稀![]() 溶液。试回答下列问题:
溶液。试回答下列问题:

①实验中观察到的现象是:铝片逐渐溶解、有大量气泡产生、______。
②产生上述现象的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题.
(1)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为H2SO4溶液),通过装置Ⅱ实现铁棒镀铜。

①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是___________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度_______;
③若实验过程中Ⅱ中的铜片质量减少了2.56g,则Ⅰ中理论上消耗CH4的体积(标准状况)______L。
(2)若将装置Ⅱ中的两电极均改为石墨惰性电极:
①写出装置Ⅱ中发生的总化学反应方式________________________________。
②若用Ⅱ电解200 mL 0.05 mol·L-1的CuSO4溶液,一段时间后溶液中的Cu2+恰好完全析出,恢复至室温,溶液pH=__________(忽略电解过程中溶液体积变化);若想将上述电解后的溶液恢复为与电解前的溶液相同,可以加入一定质量的__________(填序号);
a.Cu b.CuO c.Cu(OH)2 d.CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com