
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
【答案】A
【解析】
根据盖斯定律,利用已知的反应计算出C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)的反应热△H,利用乙醇的物质的量与反应放出的热量成正比来解答。
①H2O(g)═H2O(l)△H1=Q1kJmol-1,②C2H5OH(g)═C2H5OH(l)△H2=Q2kJmol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJmol-1,根据盖斯定律,①×3+③-②得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l),故△H=(3Q1+Q3-Q2)kJ/mol,该反应为放热反应,△H=(3Q1+Q3-Q2)kJ/mol<0;46g液体酒精的物质的量为![]() =1mol,故1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为-(3Q1 +Q3-Q2) kJ,故选A。
=1mol,故1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为-(3Q1 +Q3-Q2) kJ,故选A。


科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
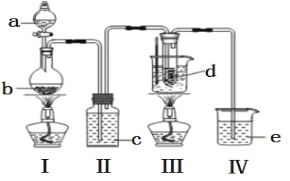
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )

A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.通过传感器可以监测空气中甲醛的含量。该传感器的原理
如图所示:

(1)该装置的主要能量转化形式是_______________。b为______极,发生的电极反应式为_________________。
(2)在传感器工作过程中,电解质溶液硫酸的浓度___________(填“增大”“减小”“不变”)。当电路中转移0.2 mol电子时,传感器内参加反应的HCHO为_______g。
Ⅱ.用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。

(1)该电解槽的阴极发生_____反应(填“氧化”“还原”)。
(2)制得的硫酸溶液从出口_______(填“A”、“D”)导出,并简述原因________________________________________________(请用化学用语和文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO2(g)![]() 3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
(1)该反应达到平衡后的熵值较平衡前______________(填“增大”“减小”“不变”)。
(2)若降低反应温度,则平衡后体系压强 p____24.00 MPa(填“大于”“等于”“小于”),原因是_____________________________________________________________________。15min 时,反应物的转化率 α=__________%
Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
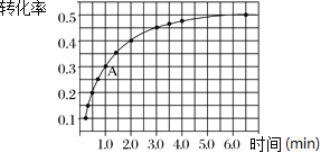
(1)要提高 NO2转化率,可采取的措施是________________ 、__________________。
(2)前2min内,以NO2表示该反应的化学反应速率为___________________。
(3)计算 A 点处v正/ v逆=_________________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有 CH2=CH2 和SO2。
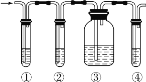
实验中提供的试剂有:A.品红溶液B.NaOH 溶液C.浓硫酸D.酸性 KMnO4 溶液试回答下列问题:
(1)写出图中①②③④ 装置盛放试剂的顺序为( 将上述有关试剂的序号填入空格内) ___________→___________→___________→___________。
(2)能说明混合气体中存在SO2 的现象是___________。
(3)能确定混合气体中存在乙烯的现象是___________。
(4)乙烯与溴水反应的化学方程式为_______,该反应的反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D 为纯净干燥的氯气与纯净干燥氨气反应的装置。

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____
(2)装置E 的作用是_____,橡胶管 k 的作用是_____
(3)装置F 中试管内发生反应的化学方程式 _____
(4)装置D 内出现浓厚的白烟并在容器内壁凝结,另一产物是空气的主要成分之一,写出该反应的化学方程式_____
(5)接入D 装置的两根导管左边较长、右边较短,目的是_____
(6)整套装置从左向右的连接顺序是(j)接______、______接(f) (g)接______ 、______接______ 、______接(a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com