
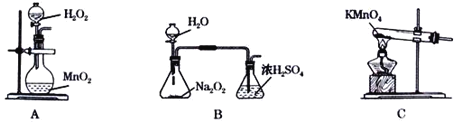
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
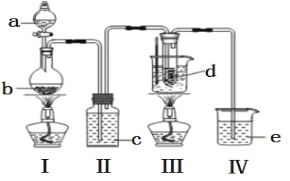
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
【答案】除去氯气中混有的氯化氢气体,避免影响产率 氯化氢气体进入装置Ⅲ消耗KOH,使KClO3产量降低 KCl ClO-+ H2O2![]() Cl-+O2↑+H2O 81.7%
Cl-+O2↑+H2O 81.7%
【解析】
氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。装置Ⅰ制备氯气,装置Ⅱ使用饱和食盐水除去氯化氢气体,氯气通入装置Ⅲ进行反应,装置Ⅳ用于尾气处理。
(1)①根据分析,装置Ⅱ的作用是除去氯气中混有的氯化氢气体,避免影响产率;②若取消装置 II,氯化氢气体进入装置Ⅲ消耗KOH,使KClO3产量降低;③在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-,故从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是KClO和KCl;
(2) ①碱性条件,ClO-有强氧化性,ClO3-氧化性较弱, H2O2溶液可以氧化ClO-而不能氧化ClO3-,从而可以进行实验测定含量。滴加足量H2O2溶液充分振荡以除尽ClO-,该过程中ClO-被还原为Cl-,H2O2溶液被氧化为O2,故发生的离子反应式为ClO-+ H2O2![]() Cl-+O2↑+H2O;②根据离子反应式定量关系式ClO3-~3I2 ~6S2O32-,故消耗20.00mL 0.600mol/L Na2S2O3物质的量为0.012mol,则25.00mL样品溶液KClO3物质的量为0.002mol,则250mL溶液KClO3物质的量为0.02mol,所含质量2.45g,质量分数为81.7%。
Cl-+O2↑+H2O;②根据离子反应式定量关系式ClO3-~3I2 ~6S2O32-,故消耗20.00mL 0.600mol/L Na2S2O3物质的量为0.012mol,则25.00mL样品溶液KClO3物质的量为0.002mol,则250mL溶液KClO3物质的量为0.02mol,所含质量2.45g,质量分数为81.7%。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_____________。
(2)反应前A的物质的量浓度是_________。
(3)10 s末,生成物D的浓度为________。
(4)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;②增大A的浓度_____;③恒容下充入氖气________。
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
(6)将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)NH3(g)+HI(g),2HI(g)H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L1,c(HI)=4mol·L1,则NH3的浓度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
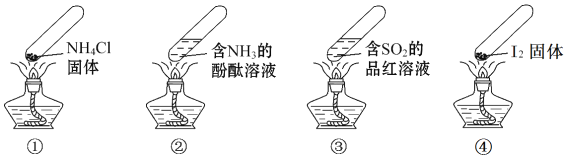
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:

(1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_______(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
___Br2 +___![]() =___
=___![]() + ___Br- +___CO2↑
+ ___Br- +___CO2↑
(3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为________________________。
(4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________(填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向一密闭容器中充入1 molN2和3 molH2,在一定条件下发生反应:N2+3H2![]() 2NH3,下列有关说法正确的是
2NH3,下列有关说法正确的是
A. 达到化学平衡时,N2将完全转化为氨
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
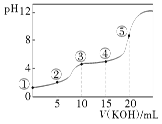
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
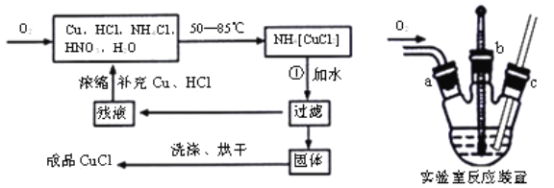
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com