
【题目】已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:

(1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_______(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
___Br2 +___![]() =___
=___![]() + ___Br- +___CO2↑
+ ___Br- +___CO2↑
(3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为________________________。
(4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________(填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯
【答案】C 3 3 1 5 3 Br2 + SO2+H2O=2 Br-+ SO42-+4H+ BD
【解析】
根据流程,海水晒盐后得到卤水和氯化钠,电解氯化钠溶液可以得到氯气,氯气将卤水中Br-氧化为Br2,得到低浓度的溴水,利用溴的挥发性,使用热空气吹出Br2用纯碱吸收,得到含有BrO3-和Br-的混合液,加入硫酸提供酸性环境,发生归中反应得到高浓度的溴水,蒸馏得到工业溴。通过步骤Ⅱ和Ⅲ使较低浓度的溴水变为高浓度溴水起到富集作用,从而降低直接蒸馏提纯的成本。
(1) Br2易挥发,故通入热空气吹出 Br2,利用了溴的挥发性,故选C;
(2)步骤Ⅱ,发生歧化反应,根据化合价升价守恒与电荷守恒、质量守恒进行配平,离子反应如下:3Br2 +3CO32-= BrO3- + 5Br- +3CO2↑;
(3)上述流程中吹出的溴蒸气可以用二氧化硫的水溶液吸收,二者发生氧化还原反应,Br2转化为Br-,SO2转化为SO42-,故二者的离子反应式为:Br2 + SO2+H2O=2 Br-+ SO42-+4H+;
(4)分离溴可以用萃取法,A乙醇可以与水互溶,不能做萃取剂,不选A;B.四氯化碳不溶于水,不跟溴反应,且溴在四氯化碳中的溶解度大于在水中的溶解度,可选B;C醋酸可以与水互溶,不能做萃取剂,不选C;D苯不溶于水,不跟溴反应,且溴在四氯化碳中的溶解度大于在水中的溶解度,可选D,故答案选BD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示![]() 已知A、B、C均为气体
已知A、B、C均为气体![]() 。
。

(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________。
(6)将质量相同但聚集状态不同的![]() 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
催化剂 | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出![]() 发生分解的化学反应方程式_______________。
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X为医用药物,它的合成路线如下:

已知:①1. RCH=CH2
②RBr ![]() RMgBr
RMgBr ![]()
③ RCHO+R’CH2CHO+![]()
(1)A的名称为______,A分子中最多______个原子共面。
(2)写出第①步反应条件______;F的结构简式______;第⑤步反应类型:______;
(3)第③步的化学反应方程式:______;G和![]() 合成聚酯纤维宇航服的化学反应方程式:______;
合成聚酯纤维宇航服的化学反应方程式:______;
(4)G经反应可得到![]() ,写出K的同分异构体中含有一个手性碳(连有四个不同取代基的碳称为手性碳原子)的结构简式______。
,写出K的同分异构体中含有一个手性碳(连有四个不同取代基的碳称为手性碳原子)的结构简式______。
(5)已知:![]() 写出由1-戊醇和必要无机试剂合成G的路线,并在括号注明条件
写出由1-戊醇和必要无机试剂合成G的路线,并在括号注明条件
1-戊醇![]() _____
_____![]() ______________(______)G。
______________(______)G。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如下所示:
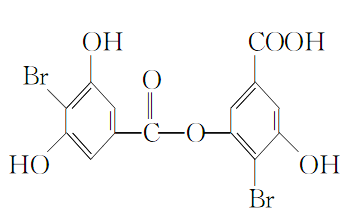
(1)M的分子式为__________。
(2)M分子中含氧官能团的名称为__________。
(3)下列有关M的叙述正确的是________(填字母代号)。
A.在浓硫酸存在时加热可发生消去反应
B.在酸性条件下可发生水解,得到两种不同的有机物
C.可与FeCl3溶液发生显色反应
D.该有机物1 mol与足量氢气充分反应,最多消耗8 mol氢气
(4)请写出M与过量热氢氧化钠溶液反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
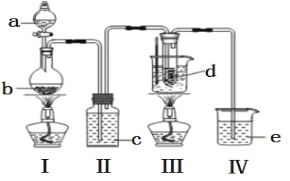
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是
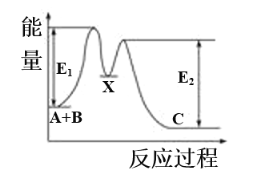
A. X是反应A+B→C的催化剂
B. 反应A+B→C的ΔH<0
C. E2表示反应X→C的活化能
D. 加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com