
����Ŀ��ij��Ӧ�����Ϊ5L�ĺ����ܱյľ��������н��У������ʵ�����ʱ��ı仯�����ͼ��ʾ![]() ��֪A��B��C��Ϊ����
��֪A��B��C��Ϊ����![]() ��
��

(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
(2)��Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ_______________��
(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����_______________��
A.v(A)=2v(B)
B.�����������ܶȲ���
C.v��(A)=v��(C)
D.����ֵ����ʵ������
E. ��������ƽ����Է����������ٸı��״̬
(4)��ͼ���ƽ��ʱA��ת����Ϊ_______________��
(5)�±��Ǹ�С���о�Ӱ���������H2O2�ֽ����ʵ�����ʱ�ɼ���һ�����ݣ���![]() ��ȡ
��ȡ![]() �����ʱ��
�����ʱ��![]() ��
��![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
������������ | ��������Ӧ | ��������Ӧ | ��������Ӧ | ��������Ӧ |
���������� | 360s | 480s | 540s | 720s |
MnO2���������� | 10s | 25s | 60s | 120s |
�ٸ��о�С������Ʒ���ʱ��������Ũ�ȡ�_______________��_______________�����ضԹ�������ֽ����ʵ�Ӱ�졣
�ڴ�����Ӱ���������ֽ����ʵ���������ѡһ����˵�������ضԷֽ������к�Ӱ�죿_______________��
(6)��������ͬ���ۼ�״̬��ͬ��![]() �ֱ���뵽5mL5%��˫��ˮ�У����ô����ǵ�ľ�����ԡ��ⶨ�����£�
�ֱ���뵽5mL5%��˫��ˮ�У����ô����ǵ�ľ�����ԡ��ⶨ�����£�
���� | ������� | �۲��� | ��Ӧ��������ʱ�� |
��ĩ״ | ��ϲ��� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5���� |
��״ | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30���� |
��д��![]() �����ֽ�Ļ�ѧ��Ӧ����ʽ_______________��
�����ֽ�Ļ�ѧ��Ӧ����ʽ_______________��
��ʵ����˵���������õĴ�С��_______________�йء�
���𰸡�2A(g)+B(g)2C(g) 0.1 mol/(Lmin) C E 40�� �¶� ���� ����Ӧ��Ũ��Խ���Լӿ췴Ӧ���ʣ������¶ȣ����Լӿ컯ѧ��Ӧ���ʣ�ʹ�ú��ʵĴ��������Լӿ컯ѧ��Ӧ���ʣ���������һ�����ɣ� 2H2O2![]() 2H2O+ O2�� ����ĽӴ����
2H2O+ O2�� ����ĽӴ����
��������
ͨ�������ʵ����ʵ����仯�����ϵ�������ȣ��ɵ÷�ӦʽΪ2A(g)+B(g)2C(g)��ͬʱͨ���仯�����Ծ��㻯ѧ��Ӧ�����Լ���Ӧ���ת���ʣ�ƽ��״̬���ж���A.v(A)=2v(B) ��û���������淽�����ж��Ƿ�ﵽƽ�⣬����B.�����������ܶȲ��䣬����ϵ�ӿ�ʼ��Ӧ��ƽ�⣬�ܶ��Ƕ�ֵû�б仯�������ж��Ƿ�ﵽƽ��״̬������C.v��(A)=v��(C)����ͬ�������淴Ӧ���ʳʼ���ϵ���ȣ������ж��ﵽƽ�⣬��ȷ��D.����ֵ����ʵ�����ȣ��������ж��������Ըijɸ����ʵ������ֲ��䣬���ж�ƽ�⣻E.��������ƽ����Է�����������ֵ�ϵ���Ħ������M������ǰ������������Ŀ�ɱ䣬�����������Է���������M�DZ���������ƽ����ж����ݣ���ȷ�����ݱ���̽��˫��ˮ��Ũ�ȡ���Ӧ���¶ȡ������Թ�������H2O2�ֽ����ʵ�Ӱ�죬��̽����ͬ������ʱ���ÿ��Ʊ�������̽���ɵý����
(1)��ͼ��ɵã�A��B��С�Ƿ�Ӧ�C�������Dz������Ӧ����2min����n��A��=2mol����n��B��=1mol����n��C��=2mol�������ʵ����ʵ����仯�����ϵ�������ȣ��ʷ�ӦʽΪ2A(g)+B(g)2C(g) ��
(2)��Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����v(B)=![]() =
=![]() =0.1 mol/(Lmin)��
=0.1 mol/(Lmin)��
(3)�ɷ����ɵã���ѡC E��
(4)��ͼ���ƽ��ʱA��ת���ʦ�=![]() ��100��=
��100��=![]() =40����
=40����
(5) �����ݱ��е����ݣ�û�д��������ȣ���ͬŨ�ȵ�˫��ˮ��������Ӧ�����������Ǽ��ȵ�����£�˫��ˮ�����ֽ⣬��˫��ˮŨ��Խ��ֽ�����Խ�죬˵����Ӧ��Ũ�Ⱥ��¶ȶԷֽ�������Ӱ�졣�Ա���������״̬���д������ȵ�����£��ֽ�����Ҳ���Լӿ죬�ʴ�Ϊ�¶Ⱥʹ��������������е����ݣ�����Ӧ��Ũ��Խ���Լӿ췴Ӧ���ʣ������¶ȣ����Լӿ컯ѧ��Ӧ���ʣ�ʹ�ú��ʵĴ��������Լӿ컯ѧ��Ӧ���ʣ�
(6) ��˫��ˮ�ڶ������̵������·�����Ӧ��2H2O2![]() 2H2O+ O2�����������������䣬��ĩ״�Ķ������̱ȿ�״�������̷�Ӧ����ʱ��Σ�˵������ĽӴ�����Է�Ӧ������Ӱ�졣
2H2O+ O2�����������������䣬��ĩ״�Ķ������̱ȿ�״�������̷�Ӧ����ʱ��Σ�˵������ĽӴ�����Է�Ӧ������Ӱ�졣


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L������A��B�������ʼ��ת����Ӧ�У�A��B���ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ����ã�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��2����Ӧ��ʼ��4 minʱ��A��ƽ����Ӧ����Ϊ____________________________��
��3��4 minʱ����Ӧ�Ƿ�ﵽƽ��״̬��________(����������������)��8 minʱ��v(��)________v(��) (������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��B���ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)2C(g)+2D(g)����Ӧ���е�10 sĩ���ﵽƽ�⣬���A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol��
(1)��C��ʾ10s�ڷ�Ӧ��ƽ����Ӧ����Ϊ_____________��
(2)��ӦǰA�����ʵ���Ũ����_________��
(3)10 sĩ��������D��Ũ��Ϊ________��
(4)ƽ������ı���������������D��������α仯(����������������С������������)��
�ٽ����¶�____��������A��Ũ��_____���ۺ����³�������________��
(5)����������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����(����)_________��
A.v(B)=2v(C)
B.������ѹǿ���ٷ����仯
C.A������������ٷ����仯
D.���������ܶȲ��ٷ����仯
E.��ͬʱ��������n mol��B��ͬʱ����2n mol��D
(6)������NH4I�����ܱ������У���ij�¶��·������з�Ӧ��NH4I(s)NH3(g)+HI(g)��2HI(g)H2(g)+I2(g)������Ӧ�ﵽƽ��ʱ��c(H2)��0.5mol��L1��c(HI)��4mol��L1����NH3��Ũ��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͼ���ɳ���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ��A���ɵ���C��D��ȼ�����ɵĵ���ɫ���塣B���������ɫҺ�壬���³�ѹ�£�D��F��K��Ϊ��ɫ�̼�����ζ�����塣H��I��ɫ��Ӧ��Ϊ��ɫ������Ӧ�����ɵIJ�����������ȥ��

��ش��������⣺
��1������A�Ļ�ѧʽΪ________��
��2����Ӧ�ٵ����ӷ���ʽΪ__________��
��3����Ӧ�ڵĻ�ѧ����ʽΪ_________��
��4������ת��H��I�ķ�Ӧ���ӷ���ʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
(1)CO2��H2��ֱ�Ӻϳɼ״�����һ�ܱ������г���CO2��H2��������Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H= a kJ/mol
CH3OH(g)+H2O(g) ��H= a kJ/mol
�ٱ����¶ȡ����һ������˵��������Ӧ�ﵽƽ��״̬����________��
A��������ѹǿ���� B��3v��(CH3OH)= v��(H2)
C��������������ܶȲ��� D��CO2��H2O�����ʵ���֮�ȱ��ֲ���
�ڲ�ò�ͬ�¶�ʱCH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ����a______0(����>������<��)��

(2)��ҵ��������Կ����е�CO���м�⡣
���Ȼ���(PdCl2)��Һ���Լ��������������CO���������к�COʱ����Һ�л������ɫ��Pd����������Ӧ����0.02 mol����ת�ƣ�������Pd����������Ϊ________��
��ʹ�õ绯ѧһ����̼���崫����������������CO��������ģ����ͼ��ʾ�����ִ�����������ԭ���ԭ������õ�صĸ�����ӦʽΪ________��

(3)ij�����ɽ�CO2��CH4ת�������ᡣ�����Ĵ�Ч�ʺ�����������������¶ȵı仯��ϵ��ͼ��ʾ�����������������Ҫȡ�����¶�Ӱ��ķ�Χ��________��

(4)�����£���һ������CO2ͨ��ʯ�����г�ַ�Ӧ����ƽ�����Һ��pHΪ11����c(CO32-)=_______��(��֪��Ksp[Ca(OH)2]=5.6��106��Ksp(CaCO3) =2.8��109)
(5)��ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ġ�ͼ4��ͨ�����ת��ԭ��������ԭ���Ʊ��²�Ʒ��ʾ��ͼ������a��b֮�����ӵ����ϵ�������������_______(����a��b������b��a��)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ������ڽ����Ȼ����Ʊ�Na��Mg��Al
B. ����![]() ��Һʱ�����ϡ�����ֹˮ��
��Һʱ�����ϡ�����ֹˮ��
C. ��һ��һ·���е�˿�����Ҫ�ɷ�����Ȼ��ά�أ����ڸ߷��ӻ����
D. ���ݵĿ�����Ca5(PO4)3OH+F-![]() Ca5(PO4)3F+OH-����ʹ�ú���������Է�ֹȣ�ݵ��γ�
Ca5(PO4)3F+OH-����ʹ�ú���������Է�ֹȣ�ݵ��γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�������м��ס����㡢��Լ����ɫ���ŵ㣬���й����ĸ������ʵ����![]() �г�װ��δ������
�г�װ��δ������![]() ����������
����������![]() ��˵����ȷ����
��˵����ȷ����
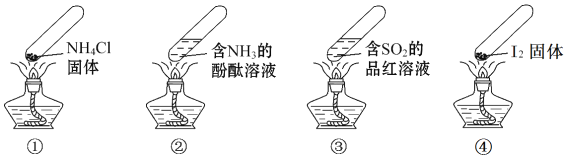
A. ����ʱ��![]() �з���ڹ�����ʧ
�з���ڹ�����ʧ
B. ����ʱ��![]() ����Һ��죬��ȴ���ֱ�Ϊ��ɫ
����Һ��죬��ȴ���ֱ�Ϊ��ɫ
C. ����ʱ��![]() ����Һ��죬��ȴ���ɫ��ȥ������
����Һ��죬��ȴ���ɫ��ȥ������![]() ��Ư����
��Ư����
D. ��������ȴ�Ĺ����У�![]() ���������仯��
���������仯��![]() ���ڻ�ѧ�仯
���ڻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ˮ�е��庬��ԼΪ 65 mg��L-1���Ӻ�ˮ����ȡ��Ĺ�ҵ�������£�

(1)������ͨ���ȿ������� Br2�����������_______(�����)��
A�������� B����ԭ�� C���ӷ��� D����ʴ��
(2)���������漰�����ӷ�Ӧ���£����ں�����������ȷ�Ļ�ѧ������:
___Br2 +___![]() =___
=___![]() + ___Br- +___CO2��
+ ___Br- +___CO2��
(3)���������д�����������Ҳ�������ö��������ˮ��Һ���գ���������������Ȼ�� ����������������������ˮ��Һ��Ӧ�����ӷ���ʽΪ________________________��
(4)ʵ���ҷ����廹��������ȡ�������п������������ȡ������________________(����ĸ)��
A���Ҵ� B�����Ȼ�̼ C������ D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L���ܱ������У�X��Y��Z(��Ϊ����)�������ʵ�����ʱ��ı仯������ͼ��ʾ��

(1)��ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ__________��
(2)��������Ӧ��X��Y��Z�ֱ�ΪH2��N2��NH3��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0mol N2��2.0mol H2��һ��ʱ���Ӧ��ƽ��״̬��ʵ�����������ʾ��
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s�ڵ�ƽ����Ӧ����v(N2)=__________��
(3)��֪������ָ�ڱ�״���£���1mol��̬����AB(g)����Ϊ��̬ԭ��A(g)��B(g)������������÷���E��ʾ����λΪkJ/mol��H-H�ļ���Ϊ436kJ/mol��N-H�ļ���Ϊ391kJ/mol������1mol NH3�����зų�46kJ����������N��N�ļ���Ϊ_________kJ/mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com