
【题目】Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO2(g)![]() 3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
(1)该反应达到平衡后的熵值较平衡前______________(填“增大”“减小”“不变”)。
(2)若降低反应温度,则平衡后体系压强 p____24.00 MPa(填“大于”“等于”“小于”),原因是_____________________________________________________________________。15min 时,反应物的转化率 α=__________%
Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
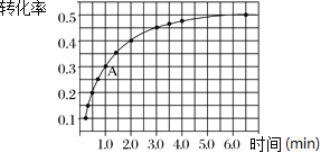
(1)要提高 NO2转化率,可采取的措施是________________ 、__________________。
(2)前2min内,以NO2表示该反应的化学反应速率为___________________。
(3)计算 A 点处v正/ v逆=_________________(保留一位小数)。
【答案】增大 小于 体积不变时,温度降低,气体分子间间隙减小,总压降低;该反应是吸热反应,降低温度,平衡逆向移动,气体分子数减少,压强降低。 45 升高温度 将生成物之一及时分离。 0.2mol·L-1·min-1 9.1
【解析】
Ⅰ.(1)熵值是反应体系的混乱度,反应3NO2(g)![]() 3NO(g)+O3(g)正方向是气体总物质的量增大的方向,则达到平衡后的熵值较平衡前增大;(2)平衡时气体的总压强为24.00MPa,在恒容条件下,该反应是吸热反应,降低温度,平衡逆向移动,气体分子数减少,压强降低,另外温度降低,气体分子间隙也减小,容器内的总压强也减小,故降温后平衡体系压强p小于24.00 MPa;在恒温恒容条件下,气体的压强与气体的总物质的量成正比,设起始时气体NO2的物质的量为nmol,则15min 时,容器内压强为23MPa,气体的总物质的量为
3NO(g)+O3(g)正方向是气体总物质的量增大的方向,则达到平衡后的熵值较平衡前增大;(2)平衡时气体的总压强为24.00MPa,在恒容条件下,该反应是吸热反应,降低温度,平衡逆向移动,气体分子数减少,压强降低,另外温度降低,气体分子间隙也减小,容器内的总压强也减小,故降温后平衡体系压强p小于24.00 MPa;在恒温恒容条件下,气体的压强与气体的总物质的量成正比,设起始时气体NO2的物质的量为nmol,则15min 时,容器内压强为23MPa,气体的总物质的量为![]() mol,则:
mol,则:
3NO2(g)![]() 3NO(g)+O3(g) △n
3NO(g)+O3(g) △n
3 3 1 1
![]() nmol
nmol ![]() mol-nmol
mol-nmol
故反应物NO2的转化率α=![]() ×100%=45%;
×100%=45%;
Ⅱ.(1)对于反应2NO2(g)![]() 2NO(g)+O2(g) ΔH>0,升高温度、减小NO或O2的浓度以及增大容器的体积,均能使平衡向正反应方向移动,提高NO2的转化率;(2)反应进行到2min时NO2的转化率为0.4,则参加反应的NO2的物质的量为0.8mol,前2min内,以NO2表示该反应的化学反应速率为
2NO(g)+O2(g) ΔH>0,升高温度、减小NO或O2的浓度以及增大容器的体积,均能使平衡向正反应方向移动,提高NO2的转化率;(2)反应进行到2min时NO2的转化率为0.4,则参加反应的NO2的物质的量为0.8mol,前2min内,以NO2表示该反应的化学反应速率为![]() =0.2mol·L-1·min-1;(3)T℃ 时反应达到平衡时NO2的转化率为0.5,则:
=0.2mol·L-1·min-1;(3)T℃ 时反应达到平衡时NO2的转化率为0.5,则:
2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
起始物质的量(mol) 2 0 0
变化物质的量(mol) 1 1 0.5
平衡物质的量(mol) 1 1 0.5
平衡时v正=v逆,即k正c2(NO2) =k逆c2(NO)·c(O2),故![]() =
=![]() =
=![]() =0.25;A点处NO2的转化率为0.3,则:
=0.25;A点处NO2的转化率为0.3,则:
2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
起始物质的量(mol) 2 0 0
变化物质的量(mol) 0.6 0.6 0.3
终了物质的量(mol) 1.4 0.6 0.3
此时,![]() =
=![]() ×
×![]() =0.25×
=0.25×![]() ≈9.1。
≈9.1。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
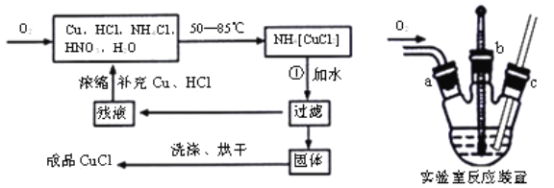
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
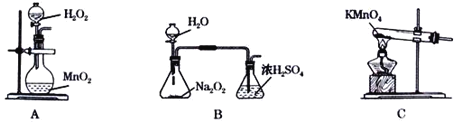
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质![]() 分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。


①若如图1所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,![]() 是________(填两种物质的化学式)。
是________(填两种物质的化学式)。
②若如图2所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是________(填序号)。
A ![]() 还原
还原![]() 的反应 B
的反应 B ![]() 的分解反应 C
的分解反应 C ![]() 和
和![]() 的反应
的反应
(2)如图3所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块铝片,再滴入![]() 稀
稀![]() 溶液。试回答下列问题:
溶液。试回答下列问题:

①实验中观察到的现象是:铝片逐渐溶解、有大量气泡产生、______。
②产生上述现象的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com