
【题目】某温度时,AgCl(s)Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 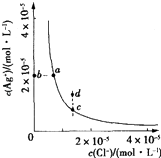
A.加入AgNO3固体,可以使溶液由c点变到d点
B.加入NaCl固体,则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.c点对应的Ksp小于a点对应的Ksp
【答案】C
【解析】解:A、加入AgNO3固体,银离子浓度增大,氯离子浓度减小,而cd点氯离子浓度相同,故A错误;
B、加入NaCl固体,氯离子浓度增大,银离子浓度减小,则AgCl的溶解度减小,但Ksp随温度变化,温度不变,Ksp不变,故B错误;
C、d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数,有氯化银沉淀生成,故C正确;
D、温度不变Ksp不变,ac点是相同温度下的溶解沉淀平衡,Ksp相同,故D错误;
故选C.
A、沉淀溶解平衡曲线上是沉淀溶解平衡,d点不是沉淀溶解平衡;
B、加入氯化钠,氯离子浓度增大,沉淀溶解平衡左移,但溶度积常数随温度变化;
C、d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数;
D、温度一定溶度积常数不变.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】关于下列各图象的叙述,正确的是( ) 
A.甲图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJmol﹣1
B.乙图表示恒温恒容条件下发生的可逆反应2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙图表示
A.B两物质的溶解度随温度变化情况,将A,B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数仍为A%=B%D.丁图表示常温下,稀释HA,HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两电池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒.(填“Fe”或“C”)
②乙池中的阳极反应式为:________________.
③乙池中总反应的化学方程式为:________________.
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:________________.
②甲池C极上的电极反应式为:________________.
③甲池中首先出现红色的是_____极;乙池中首先出现红色的是______极(填“Fe”或“C”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
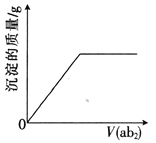
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
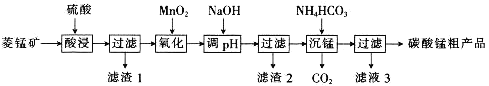
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
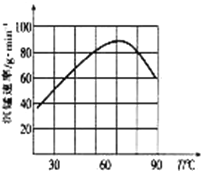
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )

A. 简单离子的半径:X<Z<M
B. 最高价氧化物对应水化物的酸性:R<N
C. Y、R两种元素的气态氢化物稳定性:Y>R
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. 
请回答下列问题:
(1)H的化学式为 .
(2)D 的电子式为 .
(3)K出反应①的化学方程式: .
(4)写出G的水溶液与C的硝酸盐溶液反应的方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年巴黎气候变化大会规定:本世纪实现温室气体净零排放.下列物质燃烧时能实现二氧化碳零排放的是( )
A.天然气
B.氢气
C.水煤气
D.煤炭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com